每日經濟新聞 2020-09-20 16:57:39
每經記者 金喆 每經編輯 文多

丁香園Insight數據庫援引國家藥品監督管理局藥品審評中心數據顯示,9月1日~9月15日,中心共承辦429例申報進度,其中受理化藥申請336項,生物制品申請73項,中藥申請17項,體外診斷試劑3項。
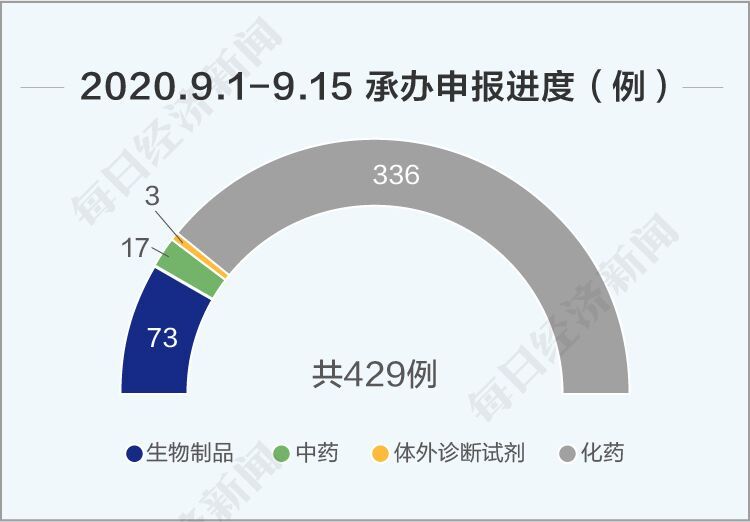
《每日經濟新聞》記者根據本期內容總結認為,中國創新藥已經嶄露頭角,但風險點仍需警惕。
一方面,生物類似藥的上市時間正在縮短,廠家必然在藥品低價格的前提下維持市場推廣力度,但也存在扎堆競爭的局面,比如本期的阿達木單抗,雖然已有3個國產品種上市,但后面仍跟隨著超過20家企業的研發項目。
另一方面,越來越多中國做best-in-class(首創)藥物的企業獲得全球認可,比如本期談到的雙抗產品,康方生物和康寧杰瑞的研發進度均在領先陣營。但從未來趨勢來看,創新藥上市后3~5年處于銷量快速上升期,銷售峰值會在競品上市或者專利到期前到來,而銷售放量又需要進入醫保目錄,這也對企業的定價帶來挑戰。
1、雙抗賽道如火如荼,恒瑞醫藥、安進/百濟神州、強生獲批臨床
根據國家藥監局藥品審評中心(CDE)最新公示,有三款雙特異性抗體獲批臨床,分別為恒瑞醫藥的PD-L1/TGF-β雙抗、安進和百濟神州聯合申報的CD3/MUC17雙抗、強生的EGFR/MET雙抗。
其中,恒瑞醫藥SHR-1701注射液適應癥為III期非小細胞肺癌(NSCLC)、晚期/轉移性胰腺癌,安進和百濟神州聯合申報的AMG199適應癥為胃癌或胃食管交界部(GEJ)癌,amivantamab注射液適應癥非小細胞肺癌。
每經點評
PD-(L)1抗體、CAR-T細胞療法等在免疫治療領域大放異彩,吸引無數企業競相布局,雙特異性抗體的細分領域研發更是在2014年成為新藥研發投資熱點。據弗若斯特沙利文預測,到2025年,雙抗研發管線的增長速度可以達到常規單抗藥物的3倍,且隨著全新雙抗進入市場,同時已上市雙抗獲批更多適應癥,市場規模將達到80億美元(約合人民幣560億元)。
《每日經濟新聞》記者注意到,雙抗在國內屬于研發稀缺品種,療效好,但研發難度大、進度慢,國內研發全部集中在抗腫瘤藥物,主要圍繞PD-1、HER2的靶點,目前還沒有產品獲批上市,都在爭奪第一張門票。
根據丁香園Insight數據庫,國內在研雙抗藥物中,PD-1/PD-L1是主流靶點,不計引進項目就有14個PD-1/PD-L1國產雙抗品種在研;其次熱門的雙抗靶點還包括CD3、CTLA4、HER2等。
在國內的研發陣營里,又分為以百濟神州和再鼎醫藥為代表的引進派,和康方生物、康寧杰瑞為代表的自主研發派。
目前國內在研的雙抗共42個品種(包括進口,在CDE有登記)。其中,雙抗項目布局最多的企業是信達生物,共6款,其中4個已經啟動臨床;從研發進展來看,康寧杰瑞的KN046最快已經進入III期臨床;此外康方生物、武漢友芝友、四川百利也是雙抗項目較多、進展較快的企業。
2、信達生物阿達木單抗獲批上市,狼來了嗎?
9月3日,信達生物(01801,HK)發布公告,用于治療類風濕關節炎、強直性脊柱炎和銀屑病的蘇立信(阿達木單抗生物類似藥)獲批上市。
每經點評
阿達木單抗是一款免疫疾病類、抗炎類處方藥物,是全球首個獲批上市的全人源抗腫瘤壞死因子單克隆抗體,原研藥修美樂是當之無愧的藥王,上市至今累計銷售超1000億美元。
但是,因為獲批適應有限、價格高、未進國家醫保目錄等原因,“藥王”在中國市場并不“吃香”。艾美達數據顯示,2018年,修美樂在中國樣本公立醫院和樣本連鎖藥店的銷售額分別僅有2120萬元和1460萬元。
“藥王”顯然不愿錯過蓬勃發展的中國市場,2019年開始降價,單價從7600元調整到3160元,2019年11月進入2019年醫保乙類目錄后,最高報銷比例達到85%,醫保支付標準為1290元。
不過,修美樂又碰上了國產仿制藥上市。2019年11月,百奧泰的阿達木單抗注射液(商品名:格樂立)順利進入國家醫保目錄,定價為1150元/支,一個月后海正藥業的安健寧獲批,定價與格樂立相同。格樂立上市后表現不錯,2020年上半年銷售額為4878.64萬元。
而且,后面的競爭將更加激烈。丁香園Insight數據庫顯示,阿達木單抗生物類似藥在研企業數量超過20家,復宏漢霖、君實生物、正大天晴的上市申請也在審評審批中。
《每日經濟新聞》記者綜合對比后發現,信達生物在過去幾款上市的藥品中,還是很擅長打價格戰的。比如貝伐珠單抗,7月10日陜西掛網報價是1188元,為目前最低;“代表作”信迪利單抗以實際年治療費用96000元成為唯一入圍國家醫保的PD-1。所以,如今信達生物成為第三家拿下該品種批文的本土企業,對于阿達木單抗市場來說,是否狼來了?我們拭目以待。
3、健康元吸入用異丙托溴銨溶液獲批上市,國內首仿
9月3日,健康元(600380,SH)發布公告稱,其4類仿制藥吸入用異丙托溴銨溶液(商品名麗霧安)獲批上市,并視同通過一致性評價。
每經點評
支氣管哮喘和慢性阻塞性肺疾病(COPD)是中國最常見的呼吸系統疾病,臨床用藥需求巨大。吸入療法可以直接作用于靶器官,提高藥物濃度,使療效最大化,同時降低藥物的全身不良反應,因此是權威指南推薦的首選給藥方式。與氣霧劑和粉霧劑相比,霧化吸入制劑的使用無需用力吸氣配合,操作難度低,尤其適合兒童和老人等操作學習能力較低的患者使用。
麗霧安是首個通過一致性評價的異丙托溴銨吸入制劑。健康元相關人士對《每日經濟新聞》記者表示,麗霧安在研發與生產過程中,嚴格控制藥品質量標準,且通過人體生物等效性研究,質量和療效與原研一致。
4、方盛制藥依折麥布片獲批上市,國內首仿
9月12日,方盛制藥(603998,SH)發布公告,公司向國家藥監局提交的4類仿制藥依折麥布片處于“審批完畢—待制證”狀態。
每經點評
依折麥布片是全球首個也是唯一一個膽固醇吸收抑制劑。原研企業為先靈葆雅,后被默沙東收購,商品名為益適純,2002年獲FDA批準上市后主要用于治療原發性高膽固醇血癥,全球銷售峰值為26億美元,2019年為5.9億美元
2006年益適純在中國獲批上市,2017年進入國家醫保目錄后銷售開始放量。米內網數據顯示,2019年中國城市公立醫院、縣級公立醫院、城市社區中心以及鄉鎮衛生院(簡稱中國公立醫療機構)終端依折麥布銷售額超過5億元,最近3年的增長率均超過40%。
因為高膽固醇血癥用藥市場較大,所以相關藥物研發的賽道吸引了眾多藥企。根據丁香園Insight數據庫,目前除原研藥外,另有4家企業正處于上市申請階段,包括蘇州華健瑞達、重慶圣華曦、北京福元三家4類仿制以及山德士制藥的5.2類進口。處于BE試驗階段的企業有6家,包括江蘇豪森、北京四環制藥等。另有29家企業已批準臨床尚未啟動。
方盛制藥作為首仿藥企,優勢明顯。方盛制藥相關人士對《每日經濟新聞》記者表示,鑒于目前高膽固醇血癥用藥市場較大,國內市場競爭較小,依折麥布片取得《藥品注冊批件》有利于進一步豐富公司產品品類,提升方盛制藥在高膽固醇血癥用藥領域的市場競爭力,從而提高整體盈利水平。目前,方盛制藥已在籌備生產前期工作,待收到《藥品注冊批件》后,將盡快安排生產,爭取在最短的時間內上市銷售。
當然,我們不能忽視默沙東益適純在渠道上的先發優勢,方盛制藥還是可以效仿其他仿制藥的經驗,先嚴控藥品質量,降價是必然。另外,我們還要看到后來的追兵,海正藥業目前在審的1類新藥海澤麥布片對標產品就是依折麥布,已被納入優先審評。
《每日經濟新聞》記者統計得知,本階段有四款藥物首次注冊上市,分別是健康元的吸入用異丙托溴銨溶液;北京百美特生物制藥有限公司的鹽酸曲美他嗪緩釋片;賽諾菲的甘精胰島素注射液和信達生物的阿達木單抗注射液。
本階段新申請的臨床試驗113項,腫瘤藥達到33個,超過1/4,感染系統藥物、心血管系統、生殖系統和內分泌系統藥物緊隨其后。
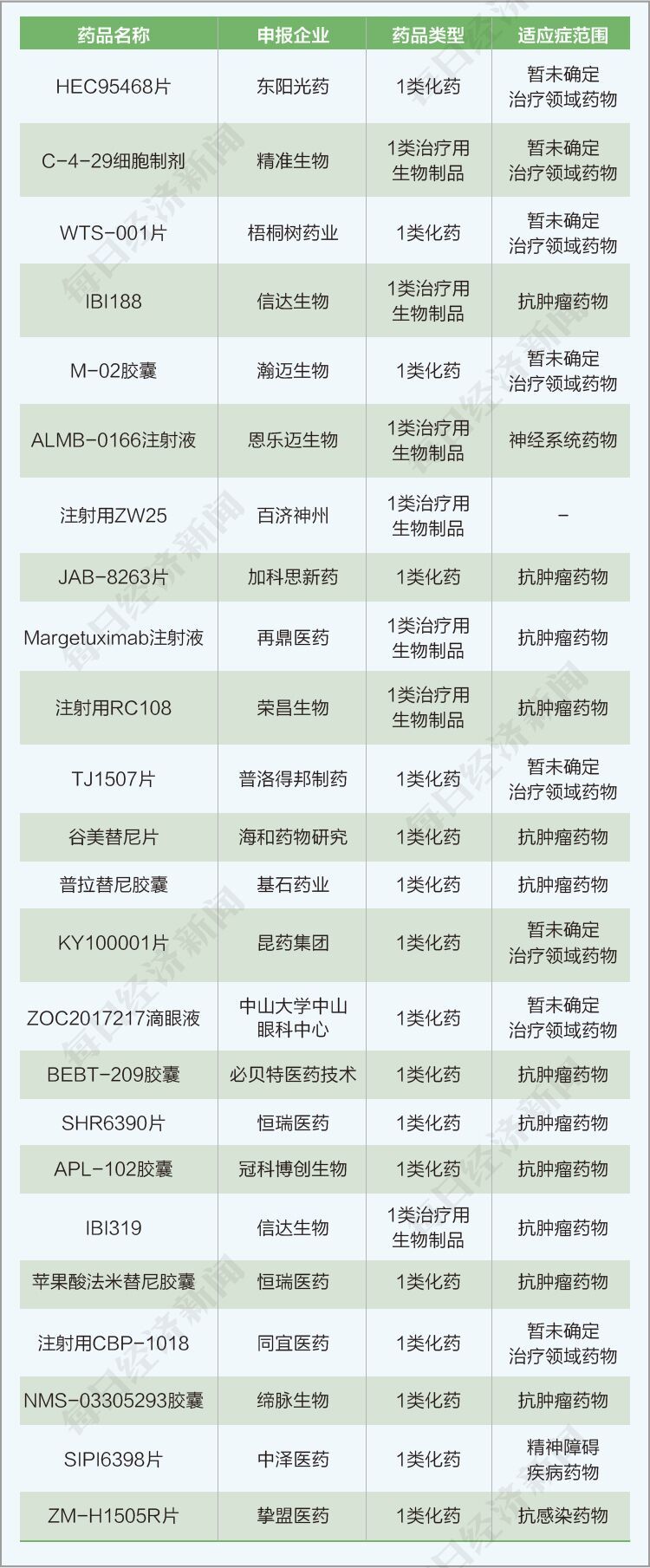
一類藥物的臨床/上市申請數量為41種(不含補充申請),占本階段藥品申報數量的6.37%,具體情況如下圖所示。
封面圖片來源:攝圖網
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
