每日經濟新聞 2021-06-09 15:48:34
◎康寧杰瑞制藥的全資子公司江蘇康寧杰瑞生物制藥有限公司遞交了恩沃利單抗注射液(KN035)臨床申請,作為全球首個用于腫瘤免疫治療的單域抗體,KN035獲批上市后將有望成為全球第一款皮下注射PD-L1抑制劑。
◎國產雙抗藥物尚無前例,未來藥物如何定價,能否適配醫保,將采取怎樣的營銷策略,都是擺在康方生物全資子公司中山康方生物醫藥有限公司自主研發的1類創新藥AK104前進道路上的難題。
每經記者 陳星 實習生 林姿辰 每經編輯 魏官紅

《掘金創新藥》由每日經濟新聞聯合丁香園Insight數據庫共同推出,旨在解讀新藥研發進展與趨勢,剖析產品競爭力與市場前景,洞察醫藥資本脈絡,見證醫藥產業高質量發展。
根據丁香園Insight數據庫統計,5月24日到5月30日,國家藥品監督管理局藥品審評中心共收到6家上市公司提交的9個化學新藥、生物制品新藥申請。
本周,恒瑞醫藥(600276.SH)、翰森制藥(03692.HK)、康方生物-B(09926.HK)各申報2個臨床申請;康寧杰瑞制藥-B(09966.HK)、海思科(002653.SZ)和百濟神州(06160.HK)各遞交1個臨床申請。
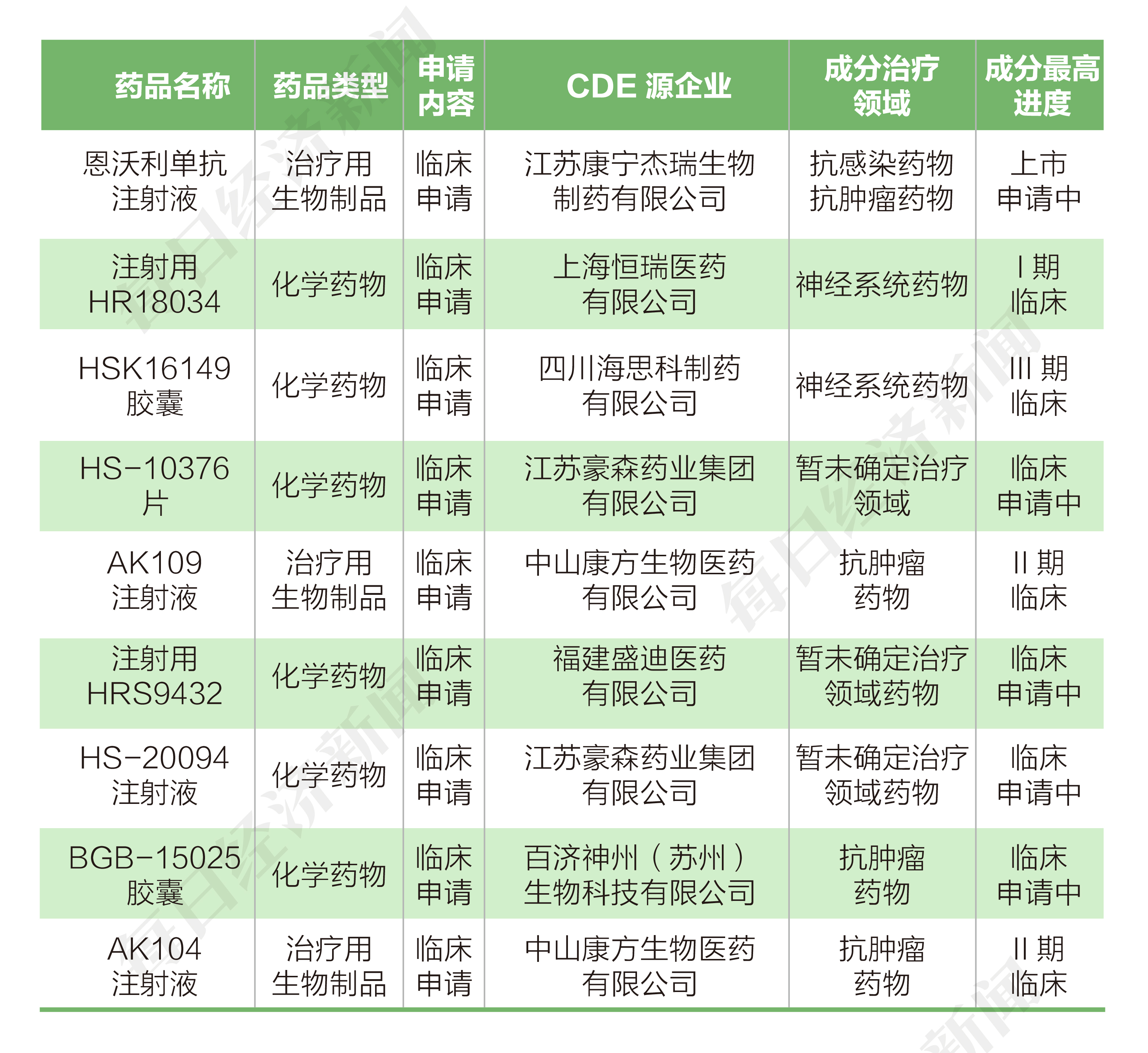
按申請類別劃分,本階段申報類別情況如下:

1、皮下注射PD-L1抑制劑再添臨床申請,康寧杰瑞制藥股價過山車
5月28日,康寧杰瑞制藥的全資子公司江蘇康寧杰瑞生物制藥有限公司遞交恩沃利單抗注射液(KN035)臨床申請。作為全球首個用于腫瘤免疫治療的單域抗體,KN035獲批上市后將有望成為全球第一款皮下注射PD-L1抑制劑。雖然KN035目前尚無適應癥獲批,但3項適應癥已經遞交上市申請,覆蓋7項適應癥的臨床研究正在進行。
康寧杰瑞方面對《每日經濟新聞》記者表示,此次申報的新適應癥是與深圳微芯西達本胺的聯合治療。
KN035是康寧杰瑞自主研發的重組人源化PD-L1單域抗體Fc融合蛋白注射液,分別由思路迪醫藥和先聲藥業(02096.HK)負責其腫瘤適應癥全球臨床開發及商業化和在中國大陸的商業化推廣。而除了藥企“抱團”的合作模式,KN035備受市場關注的原因之一在于其獨特的給藥途徑。
目前,已經上市及在研的PD-1/PD-L1抗體均采用靜脈注射,每2周或每3周就需要一次給藥。而KN035另辟蹊徑,選擇皮下注射的給藥途徑。比起靜脈注射,皮下注射不僅有安全性好、常溫穩定、注射部位限制少、單次注射量小、縮短給藥時間等優勢,還能減輕醫患雙方的時間和費用成本,更好地改善患者生活品質,可謂直面臨床痛點。
對此,西南證券表示,KN035在給藥方式方面具有明顯優勢,患者依從性更佳、更便利,覆蓋面將會更廣,在搶占市場份額上具備優勢。
從全球競爭看,目前國際上已有三種PD-L1抑制劑獲批上市,分別是默沙東的阿維魯單抗、阿斯利康的度伐利尤單抗(英飛凡)以及羅氏的阿替利珠單抗(泰圣奇)。其中,英飛凡和泰圣奇分別于2019年12月和2020年2月在國內獲批,是國內僅有的兩款獲批的PD-L1藥物。
從獲批適應癥來看,英飛凡僅有一項適應癥在國內獲批,即III期非小細胞肺癌(NSCLC);但泰圣奇有兩項適應癥在國內獲批,分別是與卡鉑和依托泊苷聯合一線治療小細胞肺癌(ES-SCLC)、聯合貝伐珠單抗一線治療肝細胞癌,是國內首個也是目前唯一一個同時擁有非小細胞肺癌和小細胞肺癌晚期一線治療適應癥的免疫抑制劑。
而KN035的適應癥與英飛凡和泰圣奇均有差異,適應癥定位于微衛星不穩定晚期結直腸癌、胃癌及其他錯配修復功能缺陷晚期實體瘤,以及膽管癌、軟組織肉瘤等。其處于上市申請階段的3項適應癥分別為晚期/轉移性胃癌、MSI-H/dMMR型結直腸癌、dMMR/MSI-H型晚期/轉移型實體瘤;處于臨床階段的適應癥有7項,分別為處于Ⅲ期臨床的晚期/轉移性膽管癌,處于Ⅱ期臨床的晚期/轉移性實體瘤、晚期/轉移性胃食管交界處癌、晚期/轉移性結直腸癌和乙型病毒性肝炎,以及處于Ⅰ期臨床的膿毒癥和休克;此外,適應癥膿毒性休克已獲臨床批準。
與此同時,未來3年至5年有望迎來雙抗藥物的上市爆發期,而康寧杰瑞在雙抗研發平臺、產品進度具有優勢,研發的KN046是全球范圍內最早進入III期臨床的PD-(L)1雙抗,平安證券直接評價康寧杰瑞制藥為“具備國際競爭力的雙抗領域龍頭企業”。
對于雙抗藥物的臨床進度,康寧杰瑞回應稱,自研雙創藥KN046的非小細胞肺癌已經進入臨床Ⅲ期,預計最快今年年底能夠看到期中分析數據;胸腺癌的美國注冊臨床正在進行中。此外,國內PD-1經治的非小細胞肺癌和胰腺癌注冊臨床也在溝通進展中。而在周末的ASCO(美國臨床腫瘤學會)上,公司剛發了3篇KN046的壁報,分別是二期非小細胞肺癌、胰腺癌和食管鱗狀細胞癌的二期。
盡管產品管線的差異優勢被廣泛看好,研發管線持續推進,但公司股價跌宕起伏。自4月21日起,康寧杰瑞制藥的股價一路高歌,由10.36港元/股增加到5月25日的25.15港元/股,漲幅高達142.76%;但在醫藥股集體大跌的市場趨勢下,其股價在過去兩周一路下行,6月4日收盤于19港元/股。

2、康方生物子公司雙抗藥AK104再申臨床,已有13個適應癥走到Ⅱ期臨床關頭
5月24日,康方生物全資子公司中山康方生物醫藥有限公司自主研發的1類創新藥AK104注射液的臨床申請獲得國家藥品監督管理局藥品審評中心批準。
作為康方生物自主研發的新型的、潛在下一代首創PD-1/CTLA-4雙特異性腫瘤免疫治療藥物,AK104旨在實現與腫瘤浸潤淋巴細胞(TIL),而不是正常外周組織淋巴細胞的優先結合,是全球首個進入臨床試驗的PD-1/CTLA-4雙特異抗體。
從研發進度來看,自2017年9月在澳洲啟動I期臨床以來,AK104分別于去年8月和10月獲得FDA(美國食品藥品監督管理局)快速通道資格和被CDE(國家食品藥品監督管理局藥品審評中心)納入突破性治療品種,如今有晚期/轉移性非小細胞肺癌,晚期/轉移性肝細胞癌,晚期/轉移性實體瘤,鼻咽癌,晚期/轉移性胃食管交界處癌,晚期/轉移性胃腺癌,晚期/轉移性胃癌,晚期/轉移性黑色素瘤,晚期/轉移性三陰乳腺癌,晚期/轉移性尿路上皮癌,晚期/轉移性鼻咽癌,外周T細胞淋巴瘤,晚期/轉移性宮頸癌共13項適應癥處于Ⅱ期臨床階段。
過去十年,隨著免疫療法成為腫瘤治療的主流,以PD-1/L1單抗為代表的免疫檢查點抑制劑有更多露出,但根據中泰證券分析,盡管PD-1/L1單抗目前已成為十余種腫瘤的標準療法,但在獲批的實體瘤適應癥中的有效率普遍在15%-30%之間,存在效率不足的問題,這就為以雙抗為重要方向的免疫聯合療法提供了登場機會。
目前,全球共有三款雙特異性抗體獲批上市,包括Trion Pharma的卡妥索單抗(Removab)、安進的倍林妥莫雙抗(Blincyto)和羅氏的艾美賽珠單抗(Hemlibra)。但從具體適應癥和銷售額來看,三者市場表現不一:因為市場表現平平,用于治療EpCAM陽性腫瘤引起的惡性腹水的Removab在2017年退市;Blincyto自2014年起先后在FDA、EMA獲批上市,去年12月,其治療成人復發或難治性前體B細胞急性淋巴細胞白血病獲NMPA附條件批準;而Hemlibra也在獲得FDA批準后于2018年經過NMPA上市,用于存在凝血因子Ⅷ抑制物的A型血友病成人和兒童患者的常規預防性治療,并在2020年成為首個銷售額進入全球TOP100的雙特異性抗體藥物。
平安證券表示,由于雙抗潛力較大,所以研發熱度較高,目前全球范圍內有217款雙抗藥物處于臨床及臨床前階段。從研發階段來看,在研管線中,有156個已經進入臨床階段,其中大多數處于臨床I期,未來3年至5年有望迎來雙抗藥物的上市爆發期。
在國內,研究雙抗藥物的公司不在少數,包括恒瑞醫藥、武漢友芝友、岸邁生物和信達生物等。而上文中提到的康寧杰瑞自研的雙抗藥物KN046處于關鍵臨床階段,與康方生物一同被視為國內雙抗領域的“康氏兄弟”。
不過,由于臨床II期成功率較低,風險較大,AK104進展順利與否仍需市場觀望;此外,已上市的Blincyto和Hemlibra價格均特別高昂,分別為17.8萬美元和48.8萬美元,而國產雙抗藥物尚無前例,未來藥物如何定價,能否適配醫保,將采取怎樣的營銷策略,都是擺在AK104前進道路上的難題。
3、康希諾吸入型新冠疫苗申請緊急使用,科興疫苗將緊急適用年齡擴大到3歲以上
過去一周,國內兩家公司的新冠疫苗捷報頻傳,熱度很快傳遞到資本市場。
其中之一是康希諾-U(688185.SH)的鼻噴霧式/吸入型新冠疫苗。6月2日,康希諾董事長兼CEO宇學峰表示,康希諾的鼻噴霧式/吸入型新冠疫苗已經進入Ⅱ期臨床試驗。次日,中國工程院院士陳薇發聲稱,鼻噴霧式/吸入型新冠疫苗正在申請緊急使用。
目前,常見的注射型疫苗僅能誘導和體液免疫、細胞免疫,但鼻噴霧式吸入型疫苗還可以形成黏膜免疫,對存在于鼻黏膜上、細胞和體液的病毒均可有效預防。同時,“免打針”的無創接種方式可能更容易被公眾接受,進而提高社會接種意愿。
首創證券認為,該鼻噴霧式/吸入型新冠疫苗與康希諾此前已經獲批附條件上市的重組新型冠狀病毒疫苗(5型腺病毒載體),在毒種、原液生產工藝、制劑生產工藝、制劑配方等均相同,僅在使用時采用霧化吸入免疫專用設備進行接種;因為劑量僅為注射劑的五分之一,若研發成功,疫苗產能和可負擔性均有望大幅提高。
受該利好消息影響,6月7日,康希諾的股價以9.66%的漲幅沖出新高度,收盤于620.70元/股。
而另一款備受關注的新冠疫苗來自科興生物(SVA)。6月5日,科興生物董事長尹衛東表示,科興中維今年初啟動了未成年人人群的臨床研究,目前已經完成了I期臨床和II期臨床。臨床研究表明,兒童組(3歲~17歲)接種疫苗之后,安全性是良好的。同時,抗體水平也和成年人一樣。
目前,國家方面已經批準科興新冠疫苗緊急使用的年齡范圍擴大到3歲以上。也就是說,我國3歲~17歲年齡段的兒童也將獲得新冠疫苗的接種安排。
科興疫苗的國際獲批事項也在上周提速。在6月1日,世衛組織(WHO)宣布將科興生物的新冠滅活疫苗正式列入“緊急使用清單”(EUL),使其成為了繼國藥疫苗之后第二家進入全球供應隊伍的國產新冠滅活疫苗。6日,科興疫苗獲得孟加拉國授權緊急使用該疫苗,中國國藥疫苗也曾于4月在該國獲批緊急使用。
而令人苦笑不得的是,科興疫苗這波遍地開花的勢頭卻因與科興制藥(688136.SH)“重名”在股市鬧出烏龍。在科興生物被WHO納入EUL的第二天(6月2日),科興制藥股價大漲20.01%。次日,科興制藥發布公告,提醒投資者自己與科興生物不存在股權關系和關聯關系。事實上,“正版科興”科興生物自2018年私有化失敗后,在美股停牌至今。
封面圖片來源:攝圖網
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
