每日經(jīng)濟(jì)新聞 2021-08-19 18:09:18
◎索元生物的7個(gè)在研藥品來源皆為外采,包括禮來、奧爾巴尼、百時(shí)美施貴寶、強(qiáng)生等。實(shí)際上,索元生物在從事一個(gè)“撿漏”的事情,就是挑別家藥企已經(jīng)宣告失敗的項(xiàng)目再進(jìn)行操作,而其中核心關(guān)鍵點(diǎn)就在于能否找到“生物標(biāo)志物”。
◎索元生物的核心產(chǎn)品,也是募投金額最多的產(chǎn)品是DB102。對(duì)于該產(chǎn)品,索元生物稱已經(jīng)發(fā)現(xiàn)了生物標(biāo)志物。“截至本招股說明書簽署日,公司核心產(chǎn)品DB102對(duì)應(yīng)的2項(xiàng)研究正處于III期臨床試驗(yàn)階段,距離提交新藥上市申請(qǐng)仍需一段時(shí)間,在此過程中可能會(huì)面臨藥品注冊(cè)審評(píng)制度的變動(dòng)”。
每經(jīng)記者 趙李南 每經(jīng)實(shí)習(xí)記者 林姿辰 每經(jīng)編輯 陳俊杰
杭州索元生物醫(yī)藥股份有限公司(以下簡(jiǎn)稱索元生物)近期遞交了招股書(申報(bào)稿,下同),擬在科創(chuàng)板IPO,募集資金16億元。
《每日經(jīng)濟(jì)新聞》記者注意到,索元生物頗有一些特殊之處,按照公司說法,其是一家以高效的精準(zhǔn)醫(yī)療技術(shù)開發(fā)多款面向全球市場(chǎng)的首創(chuàng)新藥(First-in-class)的生物醫(yī)藥公司。而索元生物的特殊性就體現(xiàn)在其所有的研發(fā)管線皆是靠外采,而其中不乏有長(zhǎng)達(dá)6年的外采研發(fā)項(xiàng)目尚未取得實(shí)質(zhì)研發(fā)進(jìn)展的情況。
此外,截至2020年底,索元生物總計(jì)有員工數(shù)43人,其中境內(nèi)員工數(shù)12人。
2018年度至2020年度,索元生物實(shí)現(xiàn)營業(yè)收入分別為0、10.35萬元和10.35萬元;實(shí)現(xiàn)歸屬于母公司所有者的凈利潤分別約為-1億元、-1.34億元和-2.23億元。
索元生物表示:“發(fā)行人處于新藥研發(fā)階段,核心產(chǎn)品尚未取得上市許可,未發(fā)生與其核心產(chǎn)品相關(guān)的銷售。報(bào)告期內(nèi),發(fā)行人的收入均為DB102商業(yè)化開發(fā)許可的期權(quán)費(fèi)收入。”
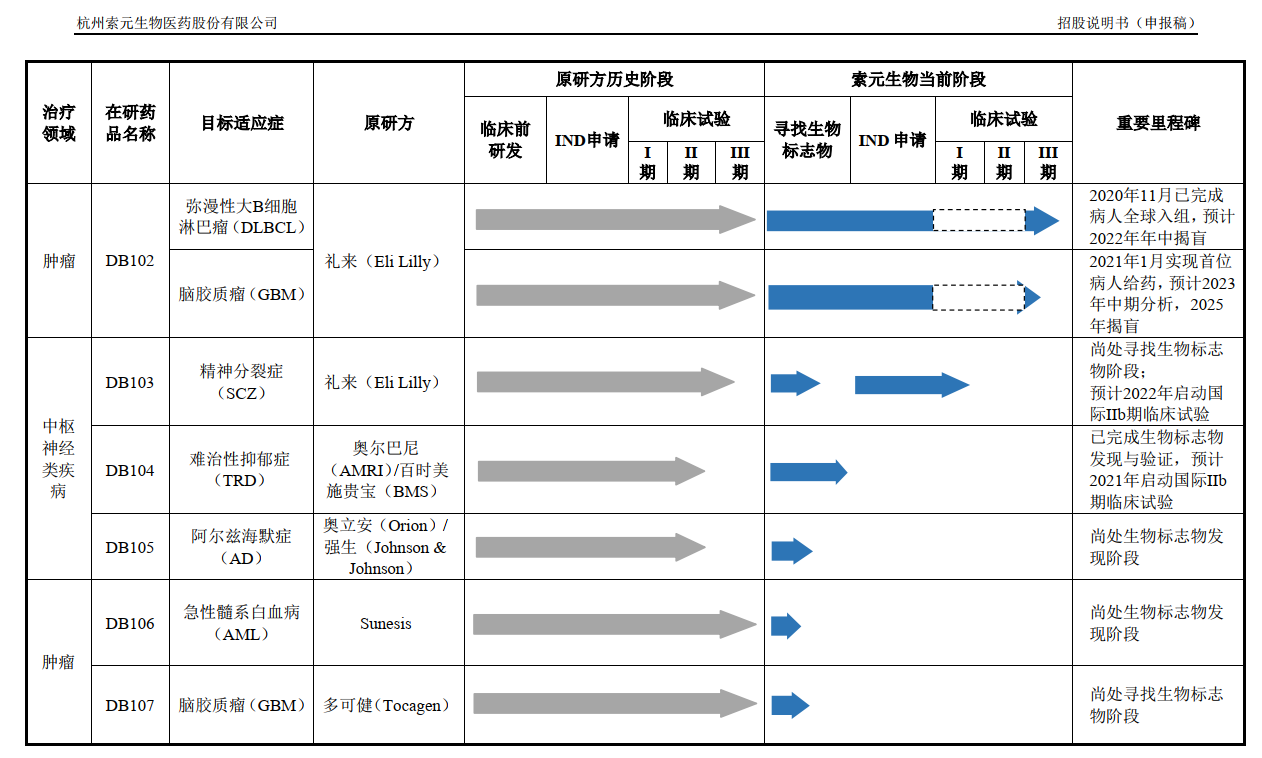
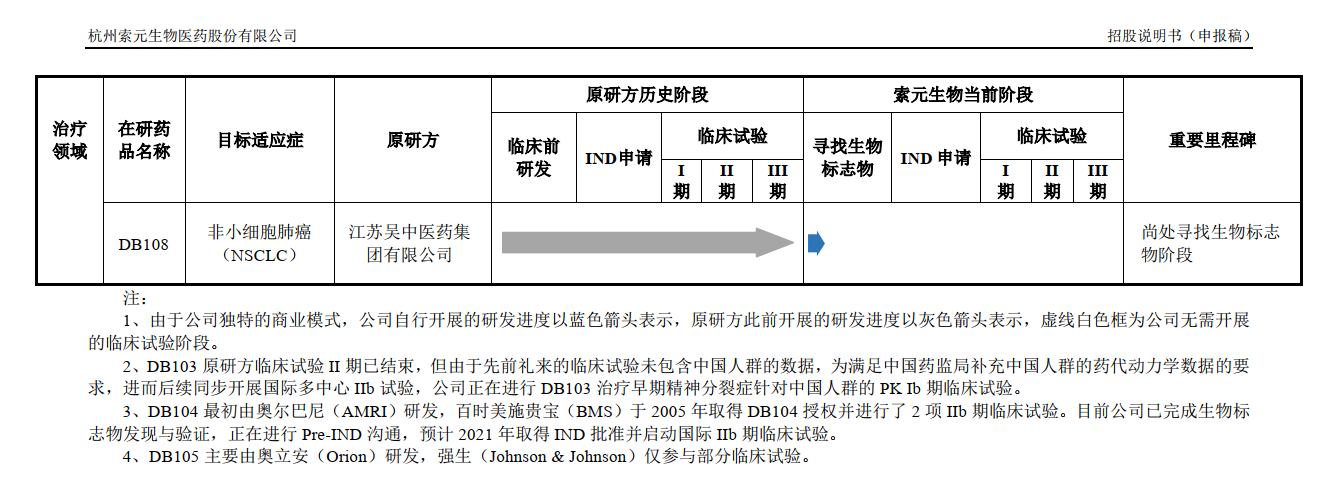
索元生物所提及的DB102是其研發(fā)管線中的一個(gè),公司以編號(hào)的方式命名研發(fā)管線,除此之外還有DB103、DB104、DB105、 DB106、DB107、DB108。
圖片來源:索元生物招股書截圖
值得注意的是,索元生物的7個(gè)在研藥品來源皆為外采,包括禮來、奧爾巴尼、百時(shí)美施貴寶、強(qiáng)生等。
對(duì)于為何沒有自主研發(fā)的藥品,索元生物表示:“公司針對(duì)未滿足臨床需求的重大疑難病癥,如腫瘤及中樞神經(jīng)類疾病,收購或引進(jìn)后期臨床試驗(yàn)失敗但已證明其安全性且顯示對(duì)部分患者有效的創(chuàng)新藥,并獲得該等創(chuàng)新藥的全球或全球絕大部分地區(qū)權(quán)益。通過公司獨(dú)特的生物標(biāo)志物發(fā)現(xiàn)平臺(tái),尋獲到經(jīng)獨(dú)立驗(yàn)證的可預(yù)測(cè)藥效的生物標(biāo)志物,進(jìn)而重新開展以生物標(biāo)志物為指導(dǎo)的國際多中心臨床試驗(yàn),最終開發(fā)出面向全球市場(chǎng)的創(chuàng)新藥。”
換句話說,索元生物在從事一個(gè)“撿漏”的事情,就是挑別家藥企已經(jīng)宣告失敗的項(xiàng)目再進(jìn)行操作,而其中核心關(guān)鍵點(diǎn)就在于能否找到“生物標(biāo)志物”。
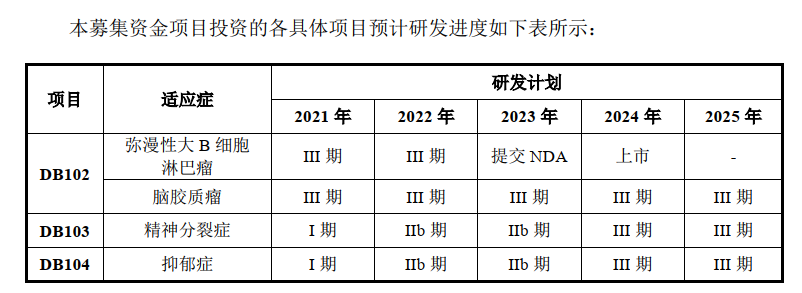
在前述的研發(fā)藥品中,DB102、DB103和DB104是索元生物的募投項(xiàng)目,擬募集投入的資金分別約為6億元、2.7億元和7億元。
圖片來源:索元生物招股書截圖
《每日經(jīng)濟(jì)新聞》記者了解到,DB103的化合物名稱為Pomaglumetad Methionil,是禮來原研的抗精神分裂藥物,臨床III 期試驗(yàn)未達(dá)預(yù)期效果。
索元生物針對(duì)該藥的研究還停留在“尋找生物標(biāo)志物階段”,“目前DB103正處于尋找生物標(biāo)志物階段。公司已完成DB103 相關(guān)樣本的全基因組掃描,正在進(jìn)行全基因組掃描結(jié)果分析”。
事實(shí)上,早在2012年8月,禮來就已經(jīng)宣布停止對(duì)pomaglumetad methionil的研發(fā)。而索元生物雖然沒有在招股書中披露對(duì)DB103的引入時(shí)間,但卻在其美國子公司官網(wǎng)上的新聞稿中披露了該藥物的引入時(shí)間為2015年3月。
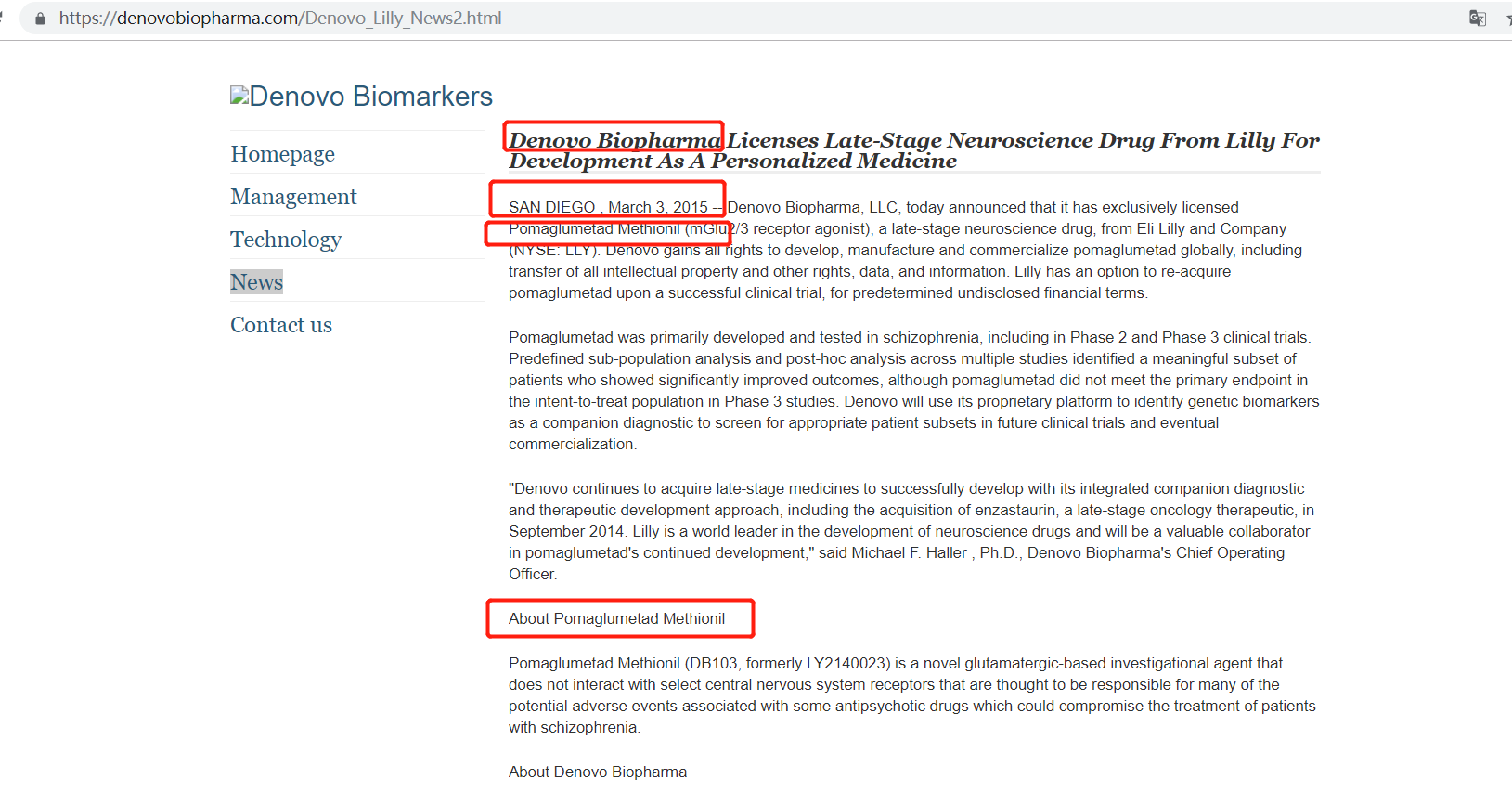
圖片來源:索元美國官網(wǎng)截圖
在上述新聞稿中,索元生物表示:“Pomaglumetad主要在精神分裂癥中開發(fā)和測(cè)試,包括在2期和3期臨床試驗(yàn)中。多項(xiàng)研究中的預(yù)定義亞群分析和事后分析確定了一個(gè)有意義的患者子集,這些患者顯示出顯著改善的結(jié)果,盡管pomaglumetad在3期研究中未達(dá)到意向治療人群的主要終點(diǎn)。索元生物將使用其專有平臺(tái)來識(shí)別遺傳生物標(biāo)志物作為伴隨診斷,以在未來的臨床試驗(yàn)和最終商業(yè)化中篩選合適的患者亞群。”
換句話說,在2015年3月,索元生物取得DB103的許可之時(shí),便已經(jīng)要進(jìn)行“生物標(biāo)志物”的識(shí)別研究,而迄今為止,這個(gè)識(shí)別已經(jīng)跨越了6年還未有成果。
相比之下,索元生物已經(jīng)宣稱發(fā)現(xiàn)的DB102的生物標(biāo)志物DGM1,DB104的生物標(biāo)志物DGM4所花費(fèi)的時(shí)間都未超過4年。
針對(duì)DB103的研究進(jìn)展問題,索元生物方面向《每日經(jīng)濟(jì)新聞》記者表示:“公司于2015年收購DB103,目前DB103正處于尋找生物標(biāo)志物階段。公司發(fā)現(xiàn)潛在生物標(biāo)志物的階段,是一個(gè)極為復(fù)雜的原創(chuàng)科學(xué)發(fā)現(xiàn)的過程,需要依賴藥學(xué)、臨床醫(yī)學(xué)、分子生物學(xué)、生物信息學(xué)、基因組學(xué)、遺傳學(xué)和統(tǒng)計(jì)學(xué)等各方面專家的緊密合作,需要極強(qiáng)的專業(yè)知識(shí)和技術(shù)訣竅(即Know-how)。此外,中樞神經(jīng)系統(tǒng)疾病發(fā)病機(jī)制尤為復(fù)雜、臨床效果較難評(píng)測(cè),均增加了中樞神經(jīng)系統(tǒng)疾病相關(guān)藥物的生物標(biāo)志物發(fā)現(xiàn)的難度。相對(duì)于腫瘤領(lǐng)域精準(zhǔn)醫(yī)療的突飛猛進(jìn),目前在中樞神經(jīng)疾病創(chuàng)新藥研發(fā)領(lǐng)域,全球范圍內(nèi)尚未有可預(yù)測(cè)藥效藥物基因組生物標(biāo)志物的獲批上市,還未實(shí)現(xiàn)零的突破。盡管公司運(yùn)用其生物標(biāo)志物開發(fā)平臺(tái)為腫瘤新藥成功發(fā)現(xiàn)生物標(biāo)志物,DB103是公司第一次嘗試將該平臺(tái)用于中樞神經(jīng)疾病。”
此外,索元生物還表示:“自公司完成DB103全球授權(quán)及技術(shù)轉(zhuǎn)移以來,公司運(yùn)用了多種組學(xué)手段進(jìn)行了全基因掃描,并開發(fā)了多種針對(duì)中樞神經(jīng)類疾病的新的算法來進(jìn)行大規(guī)模數(shù)據(jù)分析。正是受益于進(jìn)行DB103項(xiàng)目時(shí)開發(fā)出的新算法及對(duì)中樞神經(jīng)類疾病臨床試驗(yàn)終點(diǎn)的了解,公司通過其獨(dú)特的生物標(biāo)志物發(fā)現(xiàn)平臺(tái),于2019年發(fā)現(xiàn)了一個(gè)全新的與中樞神經(jīng)系統(tǒng)領(lǐng)域另外一款藥物DB104降低抑郁癥主要臨床指標(biāo)MADRS評(píng)分的高度相關(guān)的生物標(biāo)志物,命名為DGM4(Denovo Genomic Marker 4)。”
索元生物的核心產(chǎn)品,也是募投金額最多的產(chǎn)品是DB102。對(duì)于該產(chǎn)品,索元生物稱已經(jīng)發(fā)現(xiàn)了生物標(biāo)志物。
“截至本招股說明書簽署日,公司核心產(chǎn)品DB102對(duì)應(yīng)的2項(xiàng)研究正處于III期臨床試驗(yàn)階段,距離提交新藥上市申請(qǐng)仍需一段時(shí)間,在此過程中可能會(huì)面臨藥品注冊(cè)審評(píng)制度的變動(dòng)。”索元生物表示。
在招股書中,索元生物對(duì)該藥品III期臨床試驗(yàn)的進(jìn)度相應(yīng)表述為:“DB102 正在中國和美國同步開展國際多中心,一線治療彌漫性大B細(xì)胞淋巴瘤(DLBCL)III期臨床試驗(yàn)研究,已于2020年11月完成國際多中心臨床III期病人入組,預(yù)計(jì)將于2022年年中揭盲。”
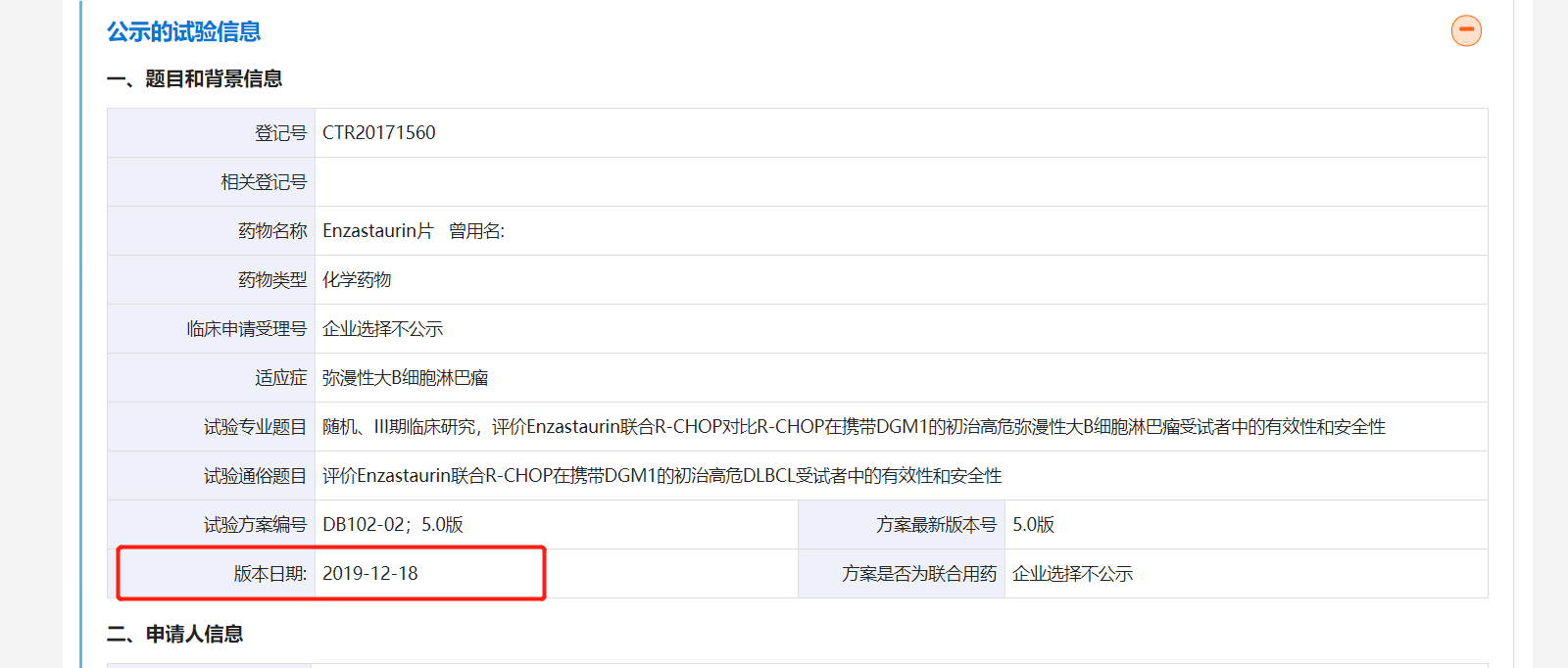
事實(shí)上,索元生物僅在招股書中描述了DB102的III 期臨床試驗(yàn)完成入組時(shí)間,但并未公布該III期臨床試驗(yàn)的開始時(shí)間。《每日經(jīng)濟(jì)新聞》記者發(fā)現(xiàn),在藥物臨床試驗(yàn)登記與信息公示平臺(tái)公示的信息顯示,DB102的III期臨床試驗(yàn)早在2018年3月就已經(jīng)開始,迄今為止已經(jīng)有3年半的時(shí)間。
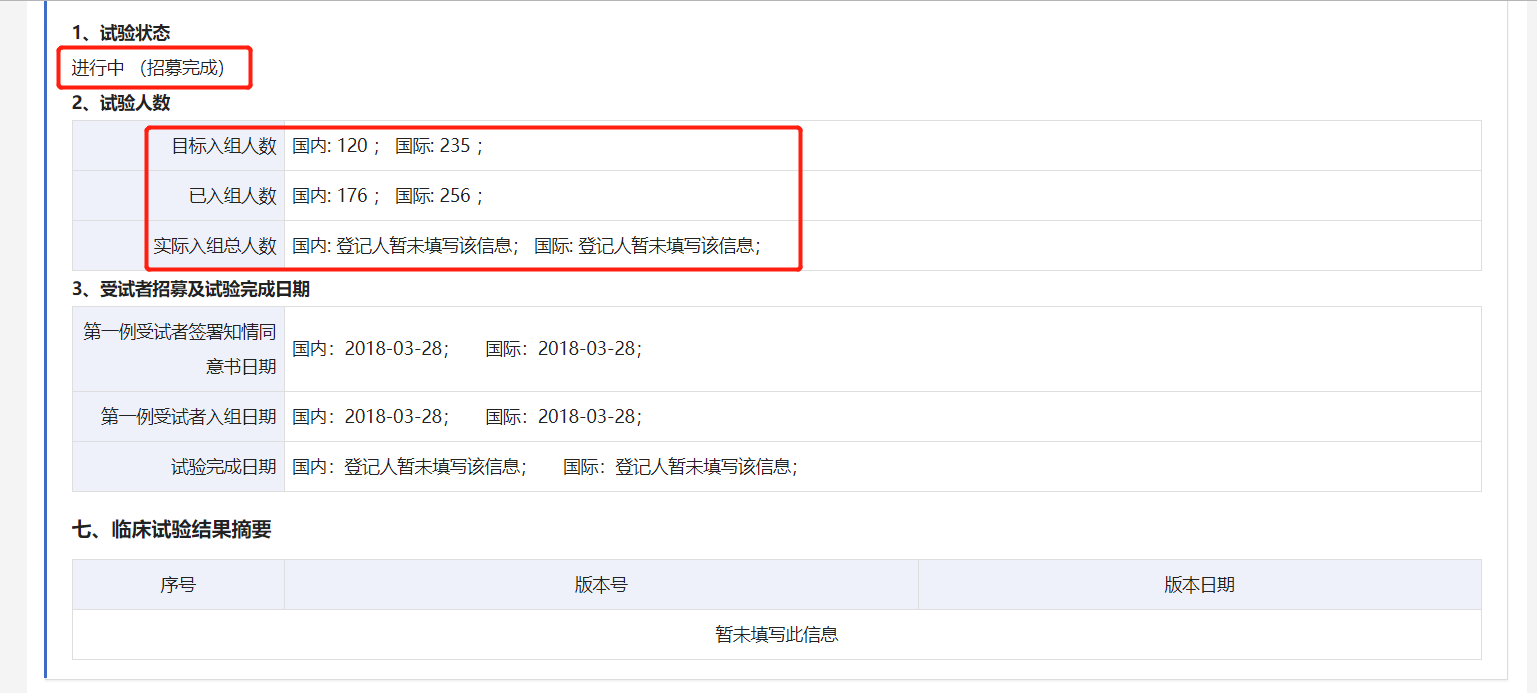
值得注意的是,編號(hào)為CTR20171560的DB102 III期臨床試驗(yàn)在2019年12月18日版本的公示信息中,已經(jīng)顯示“招募完成”,目標(biāo)入組人數(shù)為國內(nèi)120人,國際235人;已入組人數(shù)為國內(nèi)176人,國際256人。
圖片來源:藥物臨床試驗(yàn)登記與信息公示平臺(tái)截圖
為何該三期試驗(yàn)已經(jīng)持續(xù)了相當(dāng)長(zhǎng)的時(shí)間還未有結(jié)果?《每日經(jīng)濟(jì)新聞》記者向索元生物發(fā)送了采訪函。
索元生物回復(fù)稱:“DB102正在中國和美國同步開展國際多中心一線治療彌漫性大B細(xì)胞淋巴瘤(DLBCL)III期臨床試驗(yàn)研究,主要療效終點(diǎn)是DGM1生物標(biāo)志物陽性受試者的OS(OS是指從隨機(jī)分組日期至任何原因死亡日期之間這段時(shí)間)。在腫瘤領(lǐng)域,有OS、PFS、TPP、TFF、ORR、DCR、DDC等各項(xiàng)評(píng)價(jià)指標(biāo)。其中OS被認(rèn)為是腫瘤臨床試驗(yàn)中最具有臨床價(jià)值的療效終點(diǎn),所以它是本試驗(yàn)的首要臨床終點(diǎn)。但是采用OS會(huì)導(dǎo)致臨床試驗(yàn)持續(xù)時(shí)間較長(zhǎng)。相比于其他惡性腫瘤,DLBCL中位OS相對(duì)較長(zhǎng),如果以O(shè)S為臨床主要終點(diǎn),臨床試驗(yàn)通常需要較長(zhǎng)時(shí)間,例如跟本實(shí)驗(yàn)較為類似的禮來的一線治療DLBCL的臨床II期臨床試驗(yàn)用了近5年時(shí)間。”
索元生物表示:“該研究于2018年初展開,已于2020年11月完成國際多中心臨床III期病人入組,目前該試驗(yàn)的揭盲時(shí)間受到終點(diǎn)事件(受試者死亡)發(fā)生的速度等各種因素的影響,預(yù)計(jì)將于2022 年年中揭盲,從全球多中心III期臨床試驗(yàn)展開到揭盲預(yù)計(jì)耗時(shí)4年多。”
8月6日,該試驗(yàn)的中國總協(xié)調(diào)研究者,北京腫瘤醫(yī)院教授朱軍向記者表示:“這個(gè)實(shí)驗(yàn)我們還沒有揭盲,剛剛完成入組,正在收集數(shù)據(jù)整理待批,所以說這個(gè)實(shí)驗(yàn)算是入組結(jié)束,但是數(shù)據(jù)的整理還沒完。原計(jì)劃5年,基本按計(jì)劃(進(jìn)行),對(duì)這個(gè)試驗(yàn)有信心。”
封面圖片來源:攝圖網(wǎng)
如需轉(zhuǎn)載請(qǐng)與《每日經(jīng)濟(jì)新聞》報(bào)社聯(lián)系。
未經(jīng)《每日經(jīng)濟(jì)新聞》報(bào)社授權(quán),嚴(yán)禁轉(zhuǎn)載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請(qǐng)作者與本站聯(lián)系索取稿酬。如您不希望作品出現(xiàn)在本站,可聯(lián)系我們要求撤下您的作品。
歡迎關(guān)注每日經(jīng)濟(jì)新聞APP
