每日經濟新聞 2021-11-16 20:26:36
◎11月11日,歷時3天的2021年國家醫保談判終于落下帷幕。在談判的第二天,明星抗癌藥PD-1單抗登上談判桌,百濟神州、恒瑞醫藥、君實生物、信達生物產品的相關新適應癥頗受市場關注。《掘金創新藥》研究員認為,未來會有更多的PD-1藥物進入臨床階段,但除了拼速度,差異化的適應癥和迅速商業化也很重要,國家醫保談判已經成為企業躲不掉的大考。
◎與榮昌生物的維迪西妥單抗的先發優勢不同,科倫藥業注射用SKB315的主要價值在于靶點的稀缺。
◎《掘金創新藥》研究員認為,目前國內只有維迪西妥單抗和羅氏的恩美曲妥珠單抗2款HER2-ADC藥物獲批上市,短期競爭格局良好,前者在醫保談判中的議價能力較強,若成功進入醫保目錄將有利于產品迅速放量。
每經記者 金喆 每經實習記者 林姿辰 每經編輯 魏官紅

《掘金創新藥》由每日經濟新聞聯合藥渡數據共同推出,旨在解讀新藥研發進展與趨勢,剖析產品競爭力與市場前景,洞察醫藥資本脈絡,見證醫藥產業高質量發展。
根據藥渡數據,11月1日至7日,國家藥品監督管理局藥品審評中心(CDE)共收到9家上市公司提交的12個化學新藥、治療用生物制品新藥申請。

2021年國家醫保談判舉行
11月9日至11日,為期3天的2021年國家醫保談判在北京舉行,25名專家分為5組對120個左右的藥品進行藥品的準入談判。本次談判涉及恒瑞醫藥(600276,SH)、百濟神州(06160,HK)、信達生物(01801,HK)、君實生物(688180,SH)、榮昌生物(09995,HK)等多家創新藥企業;藥物類型涉及PD-1單抗、BTK抑制劑、PARP抑制劑等多種創新藥物。不過,市場傳言單價高達120萬元/針的CAR-T療法最終缺席談判,此前,市場對其參與談判的期待極高。
沃森生物mRNA加強針有最新進展
11月10日下午,科技部公示mRNA加強針獲批IIIb期臨床。沃森生物(300142,SZ)董秘張荔對外表示,這是公司新冠mRNA疫苗III期臨床的一個組成部分,公司會按照獲批的方案往下做。
11月1日,復宏漢霖申報國內首款雙抗EGFR/4-1BB雙抗HLX35。這是復宏漢霖申報的首款雙抗新藥,預計開發用于包括頭頸部腫瘤和結直腸癌在內的實體瘤,以及單抗耐藥患者。
11月2日,CDE受理了思路迪CD47單抗藥物3D197的臨床試驗申請。該藥物由ImmuneOncia開發,目前正在美國晚期癌癥受試者中開展I期臨床研究。本次申報為3D197中國首次I期臨床試驗,擬在局部晚期或轉移性實體瘤受試者和復發或難治性血液腫瘤受試者中開展。
11月4日,四川思路迪康瑞藥業的恩沃利單抗注射液上市申請審評狀態變更為“在審批”,適應癥為:微衛星高度不穩定(MSI-H)晚期結直腸癌和MSI-H晚期胃癌及其DNA錯配修復功能缺陷(dMMR)晚期實體瘤。
11月4日,信達制藥提交了信迪利單抗一項新適應癥上市申請,可用于聯合化療(奧沙利鉑+卡培他濱)一線治療不可切除的局部晚期、復發性或轉移性胃或胃食管交界處腺癌,獲得CDE受理。
11月4日,樂普生物PD-1單抗普特利單抗用于治療MSI-H/dMMR實體瘤的上市申請結束公示期,被CDE納入優先審評審批。
本周上市公司方面,康方生物(09926,HK)共申報2個臨床申請;康寧杰瑞制藥(09966,HK)、白云山(600332,SH)、信達生物、智飛生物(300122,SZ)、奧賽康(002755,SZ)、樂普醫療(300003,SZ)、復宏漢霖(02696,HK)、恒瑞醫藥各申報1個臨床申請;信達生物、恒瑞醫藥各申報1個生產申請。

1.國家醫保談判落幕,PD-1四巨頭新增適應癥分化,后入局者還能分到羹嗎?
11月11日,歷時3天的2021年國家醫保談判終于落下帷幕。在談判的第二天,明星抗癌藥PD-1單抗登上談判桌,身為國產四巨頭的百濟神州、恒瑞醫藥、君實生物、信達生物都有哪些新適應癥參與,頗受市場關注。
根據國盛證券整理的名單,信達生物的信迪利單抗注射液和百濟神州的替雷利珠單抗注射液今年的新增適應癥都涉及非小細胞肺癌和肝細胞癌,談判成敗對兩家企業的影響較大;而君實生物的特瑞普利單抗注射液涉及鼻咽癌和尿路上皮癌,恒瑞醫藥的注射用卡瑞利珠單抗涉及鼻咽癌,均為小適應癥。
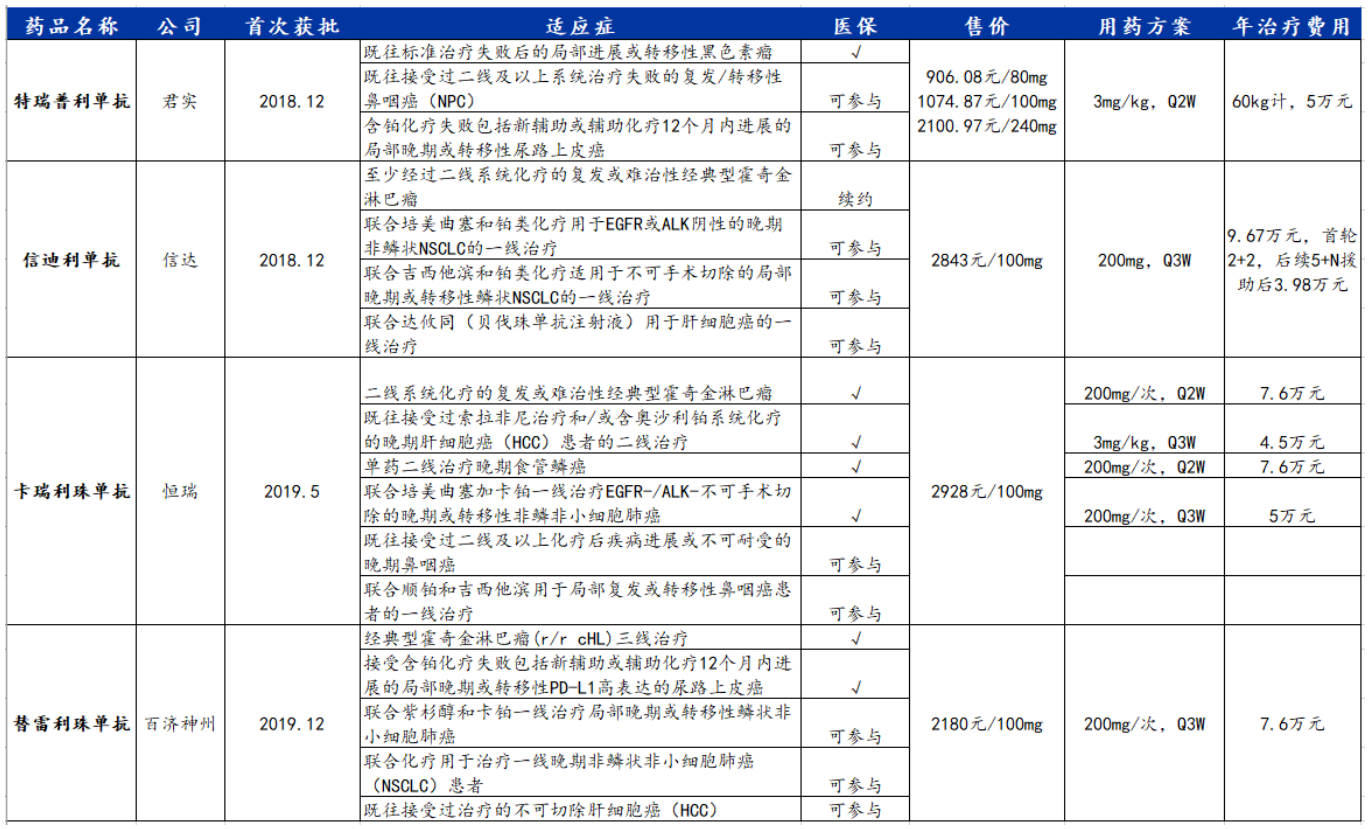
國產PD-1適應癥及進入醫保、年費情況 圖片來源:國盛證券
從此前進入醫保的適應癥看,恒瑞醫藥的卡瑞利珠單抗已經有4種大適應癥進入醫保目錄,在四家企業中優勢最大;緊隨其后的是百濟神州的替雷利珠單抗和信達生物的信迪利單抗。目前,君實生物僅有黑色素瘤一項小適應癥進入醫保目錄,今年尚無大適應癥獲批,適應癥布局相對失色。
但這只是國產PD-1產品間的比較。截至目前,百時美施貴寶的PD-1產品納武利尤單抗在全球范圍內獲批了肺癌、頭頸癌、胃癌、食管癌、肝癌等十余個大適應癥,默沙東的帕博利珠單抗的適應癥也涵蓋了肺癌、頭頸部癌、淋巴瘤、膀胱癌、胃癌、宮頸癌等大適應癥。
國產PD-1也需要朝大適應癥進擊。11月4日,信達制藥提交了信迪利單抗一項新適應癥的上市申請,用于聯合化療(奧沙利鉑+卡培他濱)一線治療不可切除的局部晚期、復發性或轉移性胃或胃食管交界處腺癌,該申請已經獲得CDE受理。
同時,國產PD-1單抗的隊列也在持續擴充。今年8月,康方生物和譽衡生物旗下的PD-1產品分別獲批上市,二者都用于治療二線以上復發或難治性經典型霍奇金淋巴瘤(r/r cHL)患者。雖然沒有拿到本次醫保談判的門票,但把PD-1單抗的價格打到了地板價。其中,康方生物的派安普利單抗每支價格為4875元/100mg,通過免費贈藥和患者救助計劃,最長2年的治療總費用低至3.9萬元;譽衡生物的賽帕利單抗的價格為3300元/120mg,但年治療費用達到8.6萬元,未來為了取得價格優勢,可能需要推出慈善贈藥降價。
而據安信證券預計,醫保談判中PD-1整體降幅可控,約在10%~20%,降價后年費將保持在3.5萬~4萬元這一水平,具體品種可能各有差異。結合四巨頭今年三季度報告,各家PD-1的銷售成績出現分化——百濟神州和信達生物的PD-1收入分別為4.9億元和8億元,而恒瑞醫藥和君實生物都沒有公布確切數字,從消息面觀察,業績或不太樂觀。
收益被一定程度壓縮,后來者是否還能分羹尚無答案,但PD-1賽道對于新兵依舊充滿吸引力。根據CDE官網,11月1日~7日,三生國健(688336,SH)、石藥集團(01093,HK)均有PD-1藥物臨床獲批,其中前者的研究面向不可切除的局部晚期或轉移性實體瘤患者,后者意在治療一線化療失敗的不可切除的、局部晚期或轉移性的膽道癌。此外,樂普生物的普特利單抗注射液新適應癥的上市申請結束公示期,正式納入優先審評,用于既往接受一線及以上系統治療失敗的高度微衛星不穩定型(MSI-H)或錯配修復缺陷型(dMMR)的晚期實體瘤患者的治療。
根據CDE數據,2020年國內臨床試驗數量最多的前10位靶點中PD-1位居第一,臨床試驗的數量將近100項。結合這一數據,《掘金創新藥》研究員認為,未來會有更多的PD-1藥物進入臨床階段,但除了拼速度,差異化的適應癥和迅速商業化也很重要,國家醫保談判已經成為企業躲不掉的大考。站在國際化和開拓新適應癥的關口上,后入局的企業要考慮的事情不少,要接受的挑戰也不小,但積極探索PD-1與其他藥物聯用,朝獨家適應癥開拓,或許是一個聰明的選擇。
2.ADC藥物前景可期:科倫藥業ADC藥物臨床獲批,中藥企業珍寶島也要入局
11月4日,科倫藥業(002422,SZ)發布公告稱,公司創新藥物注射用SKB315獲得臨床試驗通知書,擬用于治療晚期實體瘤。這是一款靶向Claudin18.2的ADC藥物。
作為近幾年抗體藥物研發的熱門,ADC藥物由單克隆抗體和強效毒性藥物通過生物活性連接器偶聯而成,是一種融合了小分子藥物細胞毒性和抗體靶向作用的強效抗癌藥物,又被稱為“智能生物導彈”,其技術前景被眾多公司看好。
國內走得最快的企業當屬榮昌生物。今年6月,維迪西妥單抗獲批上市,作為國內首個通過自主研發獲批上市的ADC藥物,其用于至少接受過2種系統化療的HER2過表達局部晚期或轉移性胃癌(包括胃食管結合部腺癌)患者的治療,這也助力榮昌生物的市值扶搖直上。
與維迪西妥單抗的先發優勢不同,科倫藥業注射用SKB315的主要價值在于靶點的稀缺。當下,全球已有10款ADC產品獲FDA批準上市,共靶向8個不同的靶點:CD33、CD30、CD22、CD79β、HER2、Nectin-4、Trop-2和BCMA。
據東興證券,2020年國內申報臨床ADC已達31件,占全球ADC臨床申報的20%。在國內已公開的在研ADC藥物中,HER2-ADC研發管線非常擁擠,已有十余家公司HER2-ADC管線進入臨床階段,其中,浙江醫藥(600216,SH)的ARX-788、東曜藥業(01875,HK)的TAA013等產品已經進展至臨床III期階段。

國內ADC靶點分布 圖片來源:安信證券
但是,全球尚未有獲批上市的靶向Claudin18.2的ADC藥物,目前同靶點單克隆抗體研發進度最領先的是日本制藥公司安斯泰來的Claudin18.s2單抗Zolbetuximab,正處于胃和胃食管交界腺癌的III期臨床試驗階段。
因此,注射用SKB315具有一定優勢,但其面臨的競爭也不小。據安信證券統計,Claudin18.2是國內ADC藥物研發中第三大熱門靶點,已經被榮昌生物、石藥集團、康諾亞(02162,HK)等企業選進研發管線,且這三家企業相應產品的臨床申請也于此前獲批。
研發的分秒必爭從側面印證了ADC藥物的市場前景。根據媒體預測,2025年ADC藥物市場規模將達到99.3億美元,復合年增長率有望達到25.9%。這吸引了諸多企業的目光,其中包括走在轉型道路上的中藥企業珍寶島(603567,SH)。
11月2日,珍寶島發布公告,擬在杭州錢塘新區內設立全資子公司,總投資約17億元,從事抗腫瘤ADC藥物研發,同時設立其他子公司及其他產業。雖然當前計劃投資總額僅為初步預估金額,實際投資規模待定,但其入局意味著,未來ADC賽道可能會出現一些“意想不到”的選手。
值得一提的是,維迪西妥單抗也參與了今年的國家醫保談判,且榮昌生物的股價在醫保談判結束的第二天(11月12日),盤中大漲8.23%,最終收盤漲幅1.06%。《掘金創新藥》研究員認為,目前國內只有維迪西妥單抗和羅氏的恩美曲妥珠單抗2款HER2-ADC藥物獲批上市,短期競爭格局良好,前者在醫保談判中的議價能力較強,若成功進入醫保目錄將有利于產品迅速放量,也會為后來ADC藥物提供價格參考。
封面圖片來源:攝圖網-401502964
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
