每日經濟新聞 2022-02-24 23:24:02
◎2月11日,CDE官網顯示,信達生物靶向CD47/PD-L1的雙抗藥物IBI322臨床申請獲得受理。靶向CD47/PD-L1的雙抗藥物IBI322是真正意義上的潛在“First-in-Class”新藥,但這款公司龍頭產品出海遇挫,信達生物亟需一款明星藥物來提振資本市場的信心。
◎開發免疫激動劑藥物是目前抗癌研發領域的重要方向,目前海內外多家藥企均有所布局。邁威生物的8MW2311此次為首次申報臨床,屬于熱門靶點快速跟進的創新藥,全球尚無同類改良型IL-2藥物上市。《掘金創新藥》研究員認為,邁威生物產品管線創新度較高,但距離其創新品種邁入商業化階段還有很長一段路要走。
每經記者 陳浩 每經編輯 魏官紅

《掘金創新藥》由每日經濟新聞聯合藥渡數據共同推出,旨在解讀新藥研發進展與趨勢,剖析產品競爭力與市場前景,洞察醫藥資本脈絡,見證醫藥產業高質量發展。
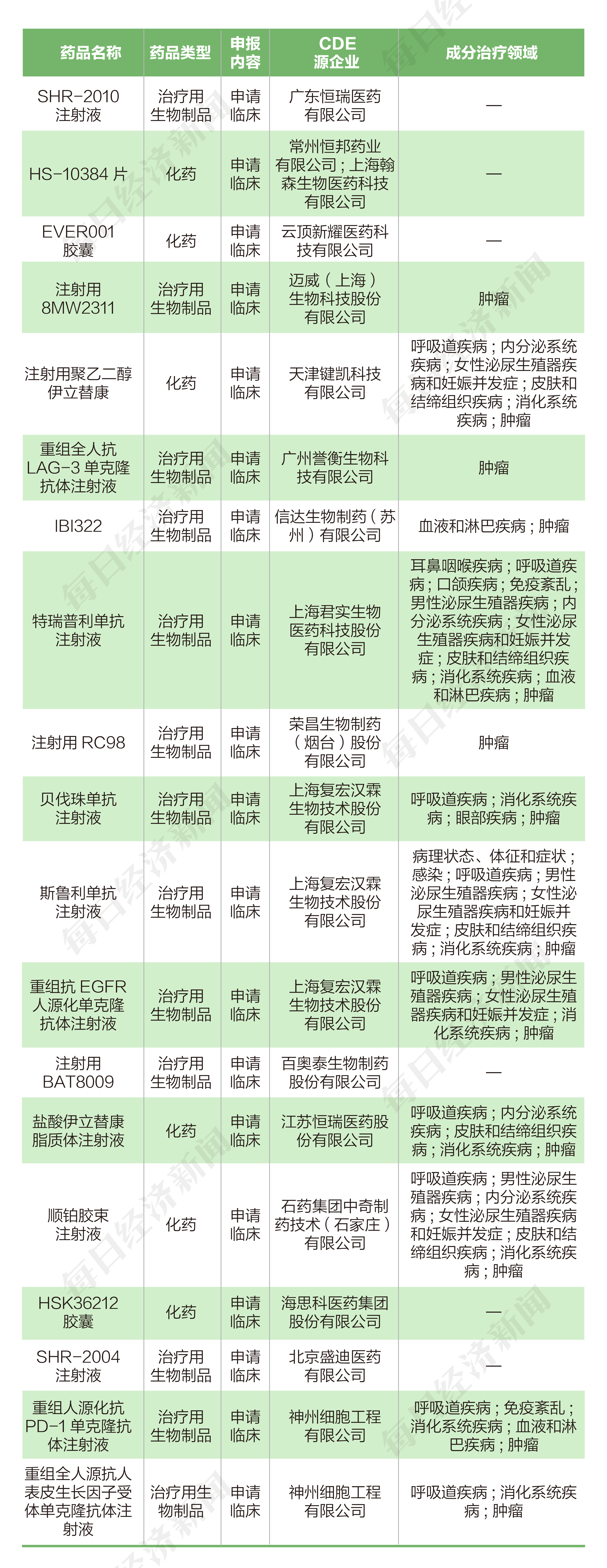
根據藥渡數據,2022年2月7日至2022年2月20日,國家藥品監督管理局藥品審評中心(CDE)共收到14家上市公司(含上市公司控股公司)提交的19個化學新藥、治療用生物制品新藥申請。


2022年2月7日至2022年2月20日期間,上市公司方面,復宏漢霖(02696.HK)和恒瑞醫藥(600276.SH)各申報3個臨床申請,神州細胞(688520.SH)共申報2個臨床申請,翰森制藥(03692.HK)、云頂新耀(01952.HK)、邁威生物(688062.SH)、鍵凱科技(688356.SH)、譽衡藥業(002437.SZ)、信達生物(01801.HK)、君實生物(688180.SH)、榮昌生物(09995.HK)、百奧泰(688177.SH)、石藥集團(01093.HK)和海思科(002653.SZ)各申報1個臨床申請。
1.信達生物CD47/PD-L1雙抗臨床申請再獲受理 能否一掃出海遇挫陰霾?
2月11日,CDE官網顯示,信達生物靶向CD47/PD-L1的雙抗藥物IBI322臨床申請獲得受理。
公開資料顯示,IBI322是信達生物開發的一款潛在“First-in-Class”重組抗CD47/PD-L1雙特異性抗體,此前已于2020年初分別在中國和美國獲批臨床,擬開發治療實體瘤和血液腫瘤。公司方面表示,IBI322能夠有效誘導吞噬腫瘤細胞及刺激T細胞活化,發揮抗腫瘤活性;IBI322更易親和腫瘤組織,從而減少靶點對正常組織的毒性并延緩耐藥的發生。
行業洞察:
據了解,CD47(重組全人源抗分化抗原簇47)蛋白是癌細胞上過度表達的免疫調節分子,與PD-1、PD-L1、CTLA-4等作用于T細胞的免疫檢查點抑制劑不同,CD47主要通過與抑制性受體信號調節蛋白α(SIRPα)作用而抑制巨噬細胞的吞噬作用,并介導多種惡性腫瘤免疫逃逸機制。
公司稱,臨床前研究顯示,IBI322可有效阻斷SIRP-α與CD47結合,誘導巨噬細胞對CD47和PD-L1共表達的腫瘤細胞發揮吞噬作用,效用與抗CD47單抗相當。另一方面,IBI322可有效阻斷PD-1與PD-L1結合,激活CD4+T淋巴細胞,效用與抗PD-L1單抗相當。
雙特異性抗體通過識別并結合兩個抗原靶點,可同時阻斷兩種信號通路,發揮出遠超單抗的治療效果,同時還能避免單一抗體潛在的副作用。雙抗藥物被認為是下一代抗體藥物新星,市場潛力巨大,國內多個創新藥企業均有布局。頭豹研究院預測,中國雙抗行業市場到2024年達到50億元規模。
IBI322是信達生物第三款進入臨床試驗階段的針對晚期惡性腫瘤治療的雙特異性抗體藥物。藥渡數據顯示,從全球范圍來看,靶向CD47/PD-L1的在研雙抗藥物共17款,其中有7款藥物處于臨床階段,進展最快的藥物處于臨床II期。
公司點評:
虎年春節后的第一周,國內創新藥行業最為關注的無疑是信達生物PD-1信迪利單抗闖關FDA遇挫。2月11日,信達生物發布公告披露,FDA腫瘤藥物咨詢委員會(ODAC)以14:1的投票結果,要求信達生物補充額外的臨床試驗,以消除目前產品“臨床試驗無國際多中心臨床研究、無頭對頭試驗”兩大不足。
目前,信達生物共有6款產品處在商業化階段,其中五款為抗腫瘤藥物,分別是信迪利單抗、貝伐珠單抗、利妥昔單抗、佩米替尼和奧雷巴替尼片,另外有一款適應證為自身免疫的阿達木單抗,上述6款商業化產品有望支撐公司短期內業績增長。信迪利單抗是公司最重要的龍頭產品,2021年上半年,信達生物實現總收入19.42億元,同期信迪利單抗的銷售收入超過14億元。目前,信達生物尚未實現盈利,2018年到2020年,公司累計虧損近85億元,但虧損已不斷收窄。
一邊是龍頭產品出海遇挫,另一邊是股價跌跌不休,2021年12月至今,信達生物股價已經腰斬。出海遇挫后,信達生物亟需一款明星藥物來提振資本市場的信心。
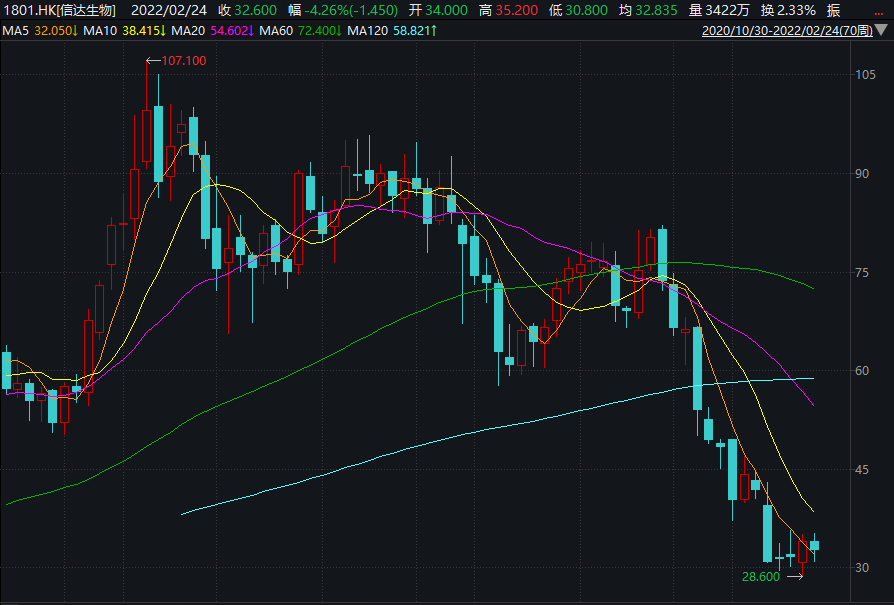
圖片來源:Wind截圖
此前ODAC公布的會議文件指出,信迪利單抗本次申報的適應證并沒有解決美國臨床未被滿足的需求。在FDA已經批準了數款PD-(L)1藥物上市,同時PD-(L)1研發競爭進入白熱化的情況下,作為一款“me-too”類藥物,信迪利單抗出海受阻也給國內創新藥的出海之路敲響了警鐘。市場分析人士認為,未來“me-too”類藥物出海難度將加大,而“First-in-Class”藥物仍有廣闊的出海空間。
《掘金創新藥》研究員認為,盡管信達生物目前尚未實現盈利,但一方面,信迪利單抗4項適應證進入醫保目錄,其適應癥擴張和持續增長的銷售表現一定程度上將緩解市場對其商業化進展的擔憂;另一方面,從管線布局來看,信達生物構建了龐大的研發管線,覆蓋腫瘤、自身免疫、心血管、眼病等領域,數十個新藥品種已進入臨床研究,其研發管線具有較大的競爭力和市場潛力。
另外,靶向CD47/PD-L1的雙抗藥物IBI322是真正意義上的潛在“First-in-Class”新藥,目前正在中美兩國分別進行臨床試驗,有了此次信迪利單抗出海受阻的經驗,公司或將會更加堅定地對“First-in-Class”新藥加大研發投入。
《掘金創新藥》研究員試圖就IBI322的相關問題采訪信達生物,公司方面回復稱,IBI322尚處于臨床早期階段,很多臨床數據還未發布,目前不便接受采訪。
2.邁威生物免疫激動劑8MW2311臨床申請獲得受理 公司目前尚無商業化產品獲批
2月15日,科創板新軍邁威生物發布公告稱,公司的免疫激動劑注射用8MW2311(以下簡稱8MW2311)臨床試驗申請獲得受理。
據悉,8MW2311是一種聚乙二醇偶聯人白介素-2免疫激動劑,擬用于治療晚期惡性腫瘤。8MW2311注射入體內后,可刺激下游轉錄因子STAT5磷酸化,有效激發殺傷性T淋巴細胞CD8+T細胞的增殖,從而發揮藥效。公司稱,臨床前研究結果顯示,8MW2311在腫瘤組織中富集并具有偏好地激活CD8+T細胞的藥理作用,在多種腫瘤模型中顯示出持續有效的抑瘤作用,并且與免疫檢查點藥物(如抗PD-1抗體)聯用能表現出顯著性增強的協同抑瘤效果。
行業洞察:
在經過化療、分子靶向治療之后,如今腫瘤治療的新藥研發已邁入了免疫治療時代。對于腫瘤免疫治療,一般來說有兩種思路,一是通過藥物松開被癌細胞故意死死拽住的剎車,讓抗癌的免疫細胞順利殺死癌細胞,現如今研發競爭火熱的PD-1、PD-L1、CTLA-4等抗體藥物均屬于這一類。
另一種思路就是通過藥物給抗癌的免疫細胞“加油”,讓免疫細胞更有力地殺死癌細胞,此次邁威生物申報臨床的免疫激動劑8MW2311即屬于這一類。根據公司招股書,8MW2311靶點為PEG-IL2,屬于融合蛋白類藥物,擬申請適應證為黑色素瘤、腎細胞癌等。
開發免疫激動劑藥物是目前抗癌研發領域的重要方向,目前海內外多家藥企均有所布局。邁威生物的8MW2311此次為首次申報臨床,屬于熱門靶點快速跟進的創新藥,全球尚無同類改良型IL-2藥物上市。
公司點評:
邁威生物是科創板新軍,公司于今年1月剛剛在科創板掛牌上市。邁威生物也是一家年輕的創新型生物制藥企業,專注于抗體藥物的研發。公司稱,將堅持以臨床亟需的生物類似藥為先導,以快速跟進和同類首創為主導的研發及商業化策略。
在管線布局上,邁威生物覆蓋自身免疫、腫瘤、代謝、眼科、感染等治療領域,現有15個在研品種處于不同研發階段,其中3個品種已提交上市申請。根據招股書,邁威生物與君實生物合作開發的9MW0113的上市申請已獲受理,目標適應證為類風濕關節炎等,預計2022年第一季度獲得上市批準;公司自主研發的9MW0311和9MW0321的上市申請也獲得了受理,目標適應證分別為骨折高風險的女性絕經后骨質疏松癥和預防實體瘤骨轉移患者發生骨相關事件,預計2023年獲得上市批準。
值得注意的是,上述三款申報上市的產品均為生物類似藥,存在無法獲得適應證外推導致的商業價值降低風險。同時,上述三款生物類似藥上市后將面臨激烈的市場競爭和帶量采購帶來的價格壓力。
目前,邁威生物尚無商業化產品面世,未產生產品銷售收入。根據公司此前發布的2021年業績預告,公司預計2021年歸母凈利潤為-6.66億元到-7.82億元。2018年到2020年,公司累計虧損約18億元。上市一個月以來,公司股價較發行價累計跌去約四成。
《掘金創新藥》研究員認為,邁威生物15個在研品種中,有11個創新品種和4個生物類似藥,產品管線創新度較高,但距離其創新品種邁入商業化階段還有很長一段路要走。在相同適應證已有數款產品獲批上市的情況下,生物類似藥9MW0113上市后將面臨激烈的市場競爭,其上市后的銷售情況還未可知,能否解“燃眉之急”還有待觀察。
《掘金創新藥》研究員試圖就8MW2311的相關事宜采訪邁威生物,并按要求將采訪函發送至指定郵箱,截至發稿尚未獲得回復。
封面圖片來源:攝圖網-500802625
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
