每日經濟新聞 2022-09-30 14:54:45
◎9月17日,國家醫保局發布了一份正式通過形式審查的藥品名單,藥明巨諾的CAR-T產品現身其中。值得注意的是,目前國內至少9家企業的CAR-T產品進入臨床階段。從適應癥看,CAR-T產品在血液腫瘤中應用廣泛,目前全球共上市8款CAR-T產品,針對的適應癥均為血液腫瘤。
◎信達生物申報的1類新藥IBI333獲得一項臨床試驗默示許可,適應癥為新生血管性年齡相關性黃斑變性(AMD)。信達生物2022年半年報顯示,IBI333是一款VEGF-A/VEGF-C雙特異性抗體。這是全球首款獲批臨床的抗VEGF-A/VEGF-C雙抗,也是信達生物在眼科領域獲批臨床的第3款雙特異性抗體藥物。
每經記者 林姿辰 每經編輯 魏官紅
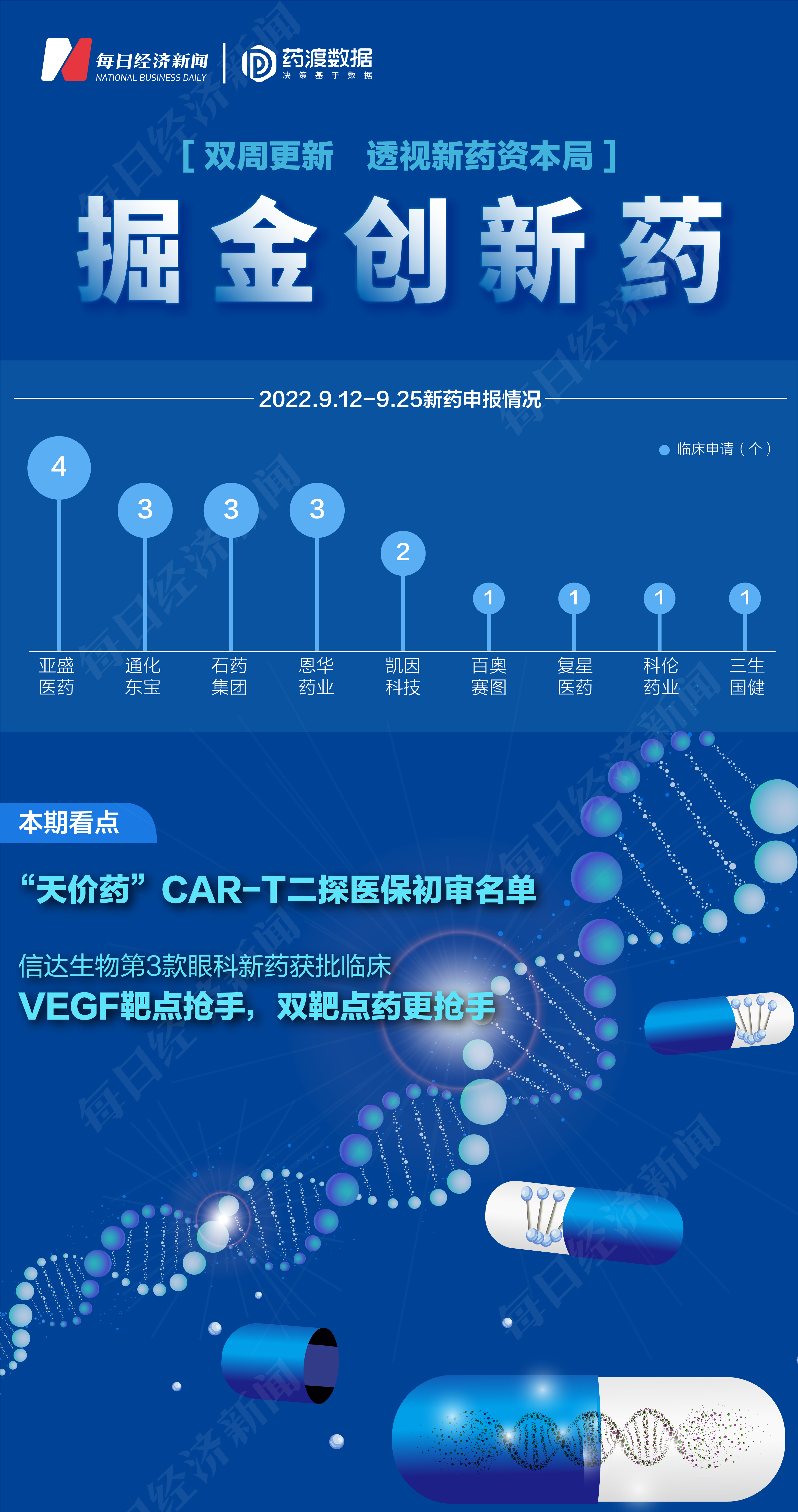
《掘金創新藥》由每日經濟新聞聯合藥渡數據共同推出,旨在解讀新藥研發進展與趨勢,剖析產品競爭力與市場前景,洞察醫藥資本脈絡,見證醫藥產業高質量發展。
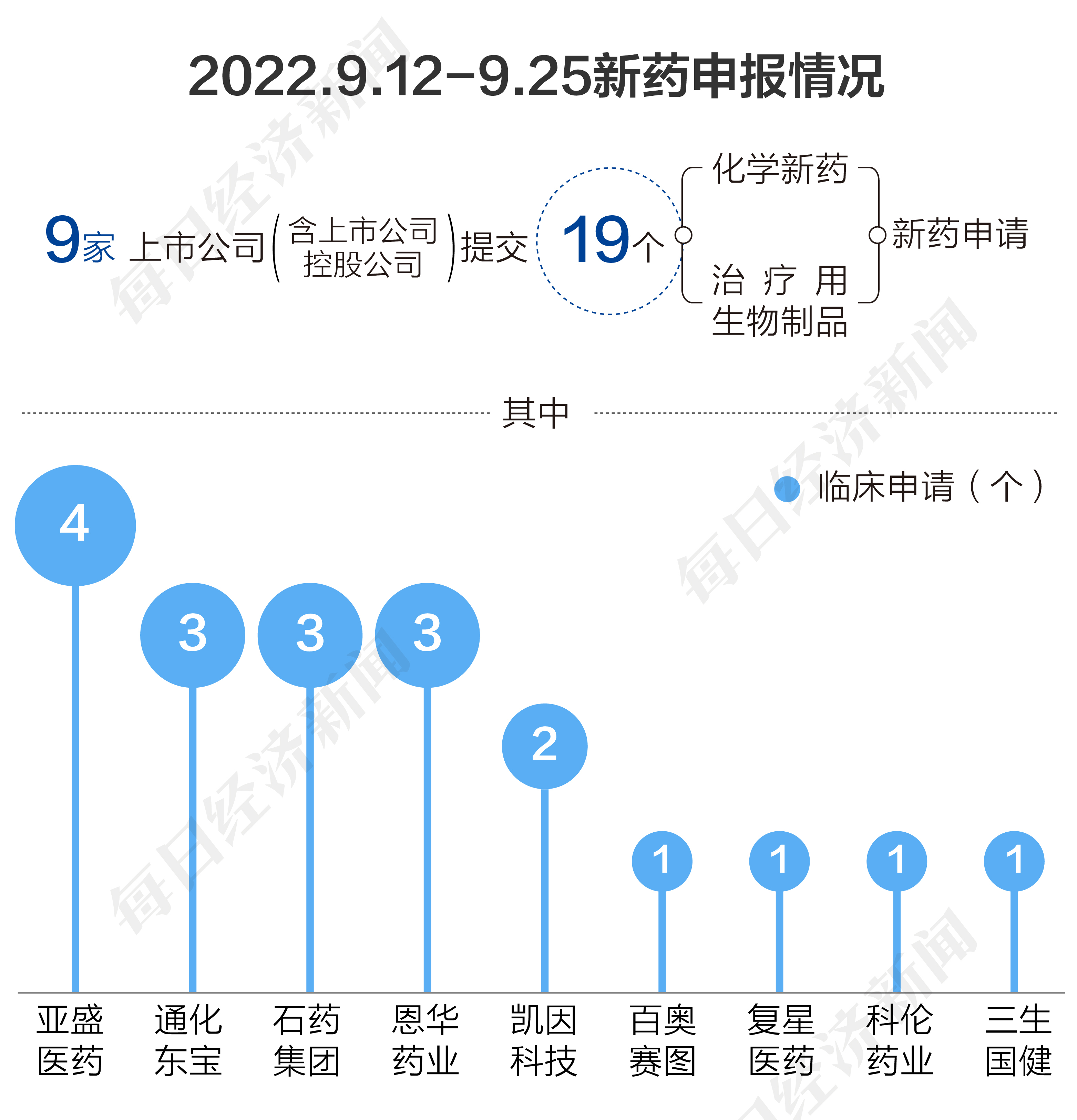
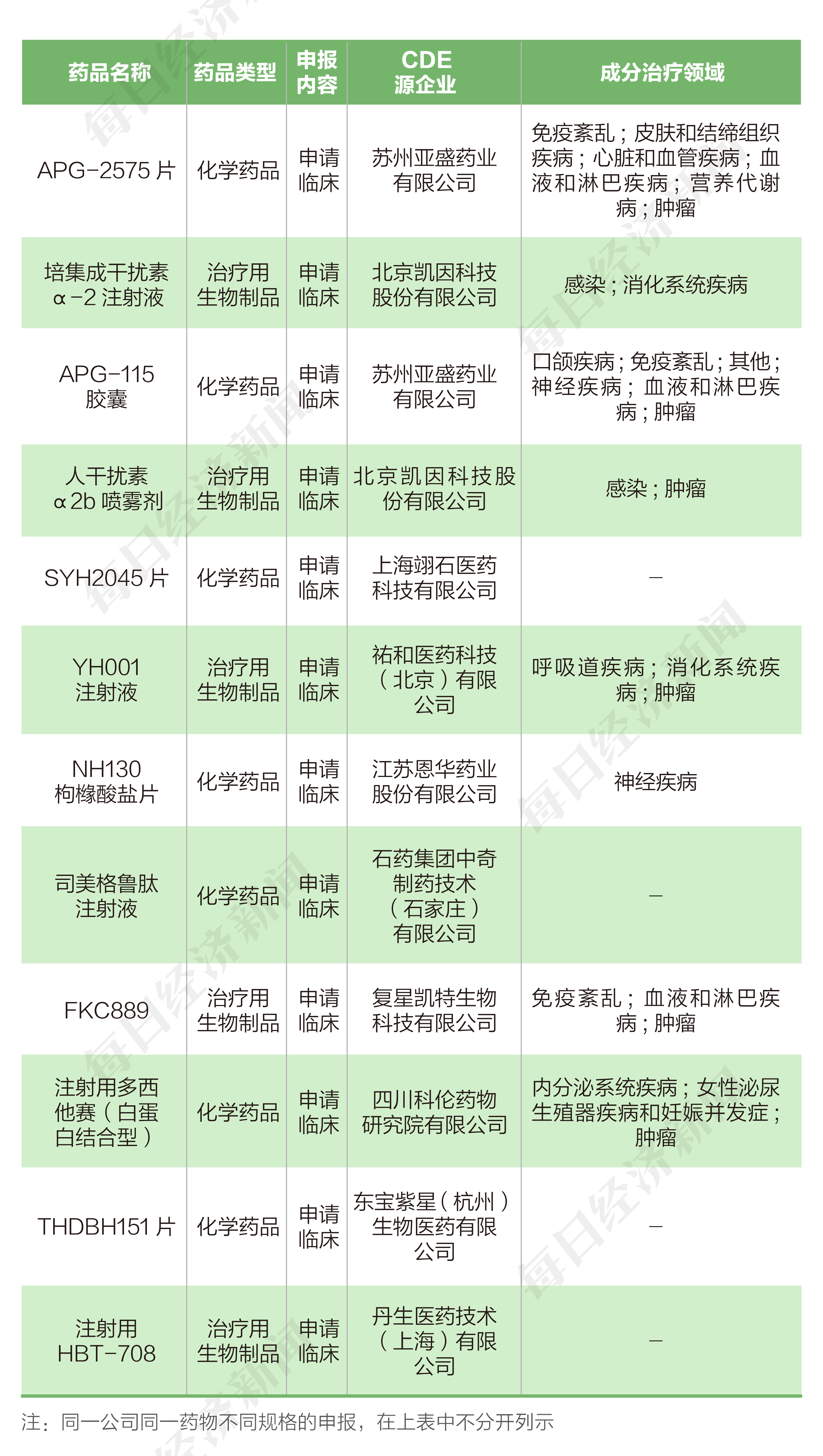
根據藥渡數據,2022年9月12日至2022年9月25日期間,國家藥品監督管理局藥品審評中心(CDE)共收到9家上市公司(含上市公司控股公司)提交的19個化學新藥、治療用生物制品新藥申請。

1、藥明巨諾CAR-T產品現身醫保初審名單,這次“闖關”將帶來什么?
9月17日,國家醫保局發布了一份正式通過形式審查的藥品名單,藥明巨諾(HK02126,股價3.18港元,市值13.07億港元)的CAR-T產品現身其中,當前用藥金額為129萬元/年。
值得一提的是,作為國內首款獲批上市的CAR-T產品,復星凱特的阿基侖賽注射液定價上百萬元,也曾出現在去年醫保目錄初步形式審查名單中,但最終沒有走到談判環節,市場猜測其很可能未通過專家評審。
行業洞察:
從2017年8月諾華公司的Kymriah獲得FDA(美國食品藥品監督管理局)批準上市算起,CAR-T產品真正用于治療癌癥的歷史不過短短5年,這種靠人工改造T細胞并將其注入人體“清除”癌細胞的免疫療法,被市場寄予了“終結癌癥”的厚望。
Frost&Sullivan預測,2021年國內CAR-T療法的市場規模約為人民幣2億元,2030年將增至人民幣289億元,2022年至2030年的復合年增長率為45%。
據華安證券8月研報梳理,目前國內至少9家企業的CAR-T產品進入臨床階段,除了復星凱特和藥明巨諾已獲批上市的產品,今年,南京傳奇生物和美國強生公司合作的針對復發或難治多發性骨髓瘤的Cilta-cel已相繼在歐盟、美國和日本三地獲批上市(歐盟為附條件上市)。
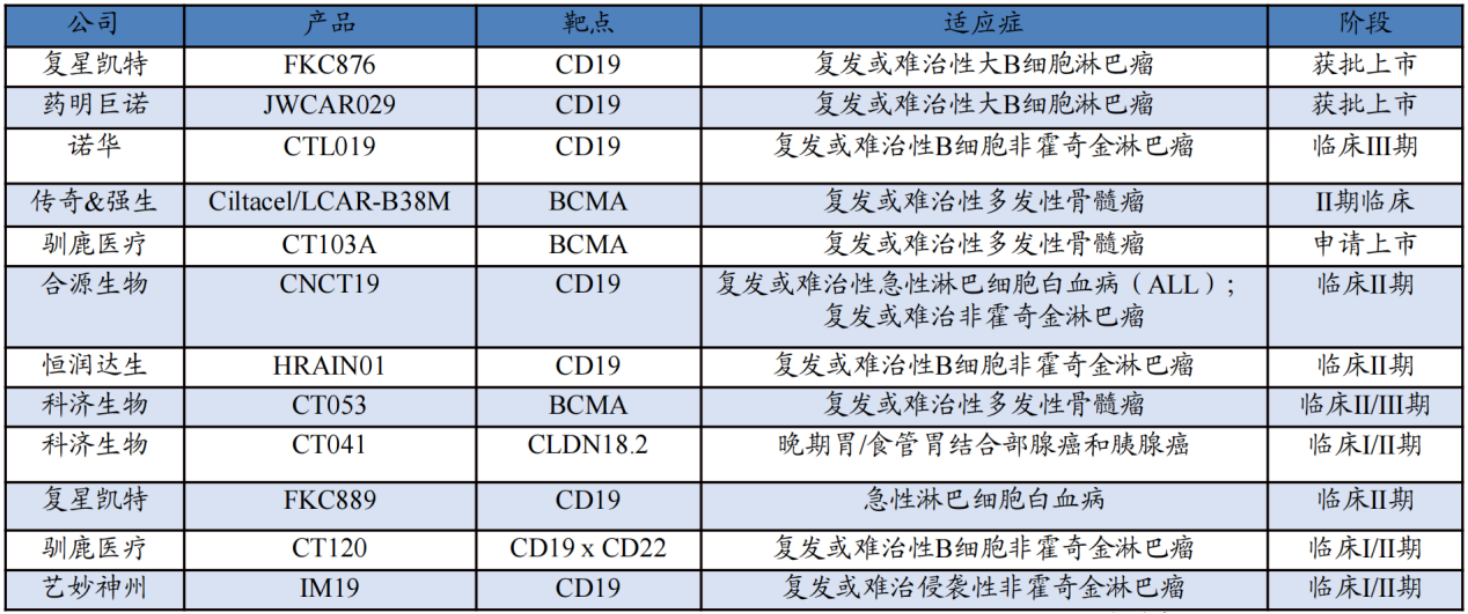
國內已有兩個CAR-T產品獲批 圖片來源:華安證券研報
從適應癥看,CAR-T產品在血液腫瘤中應用廣泛,目前全球共上市8款CAR-T產品,針對的適應癥均為血液腫瘤。在這8款CAR-T產品中,除了Abecma和西達基奧倫賽注射液以BCMA為靶點,其他6款CAR-T產品均以CD19作為靶點。高價是它們最大的共同點。
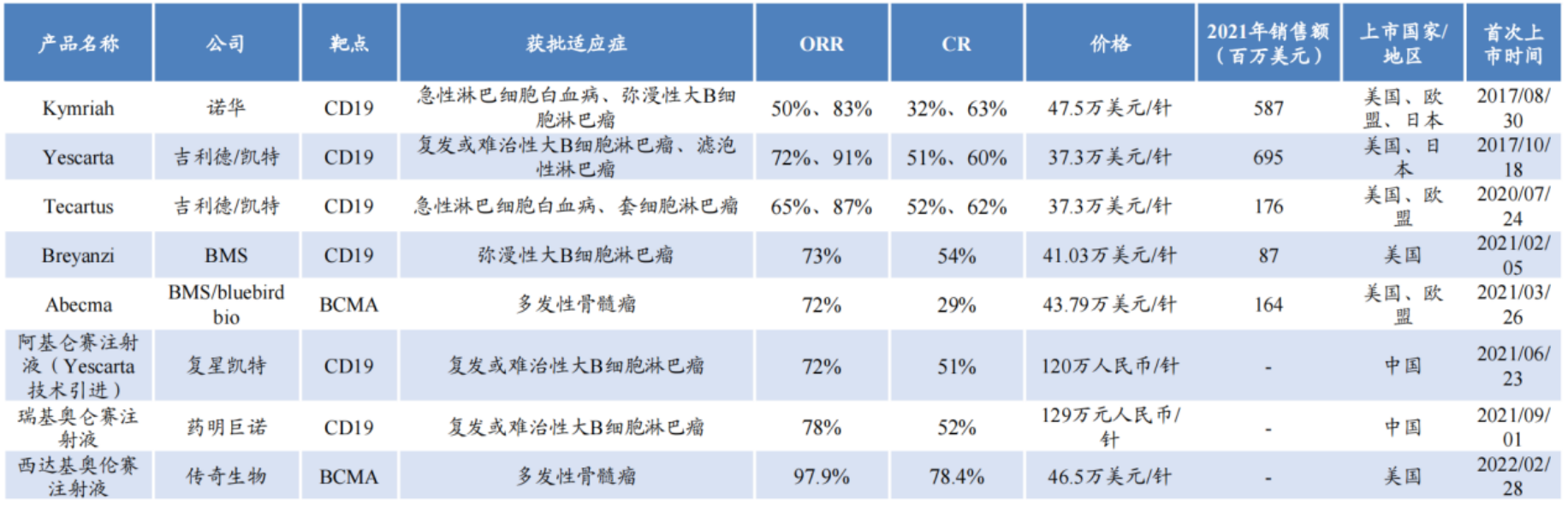
全球已上市CAR-T產品基本信息 圖片來源:華安證券研報
公司點評:
今年上半年,藥明巨諾實現營收6600.7萬元,上年同期收入為0元;期間虧損4.29億元,同比擴大53%。
收入的增加源于藥明巨諾僅有的一款商業化產品,即靶向CD19自體CAR-T細胞免疫治療產品“倍諾達”。去年9月,該產品獲批上市,用于治療經過二線或以上系統性治療后成人患者的復發或難治性大B細胞淋巴瘤,成為中國首個獲批為1類生物制品的CAR-T產品。
對應翻倍增長的是公司的銷售費用。今年上半年,藥明巨諾銷售開支由上年同期的4617.6萬元增加到8444.7萬元,主要是由于商業團隊的員工成本增加,以及2021年下半年開展的支持倍諾達商業化的活動,推高了業務推廣費。
從結果看,公司在上半年開具了77張倍諾達處方,完成了64位患者的回輸,并在國內83家醫院完成了培訓、試運行及評估,認證該等醫院合資格使用倍諾達。截至2022年8月,藥明巨諾建立了一個由100名左右不同專業的員工組成的商業團隊,涵蓋銷售團隊、市場團隊、CAR-T顧問團隊、創新支付團隊、渠道管理和醫院準入團隊。
不過,CAR-T產品的高價格、生產時間、嚴格的運輸條件都被視作商業化的阻礙,而醫保“保基本”的定位目前還較難接納定價上百萬元的CAR-T產品,也使此次通過形式審查的藥明巨諾的CAR-T藥品備受關注。
9月29日,公司方面對《每日經濟新聞》記者表示,國家醫保也是提升產品可及性的有效方式。通過參與此次國家醫保藥品目錄調整,藥明巨諾希望讓更多利益相關方對創新的細胞免疫治療產品有深入了解,分享國外的相關經驗,并了解創新產品被納入國家醫保支付的準入要求,進一步探討提升產品可及性的創新方式與途徑,助力完善多層次保障體系的建設,讓突破性的產品惠及更多患者及家庭。
2、信達生物第3款眼科雙抗新藥獲批臨床:VEGF藥物搶手,雙靶點更搶手
9月19日,CDE官網顯示,信達生物(HK01801,股價25港元,市值382.01億港元)申報的1類新藥IBI333獲得一項臨床試驗默示許可,適應癥為新生血管性年齡相關性黃斑變性(AMD)——根據世界衛生組織統計,這是目前繼青光眼、白內障之后全球第三大致盲因素,也是60歲以上人群失明的主要原因。
信達生物2022年半年報顯示,IBI333是一款VEGF-A/VEGF-C雙特異性抗體。這是全球首款獲批臨床的抗VEGF-A/VEGF-C雙抗,也是信達生物在眼科領域獲批臨床的第3款雙特異性抗體藥物。
行業洞察:
目前,抗VEGF藥物是治療視網膜病變的主要藥物,而AMD是常見的一種視網膜病變,分為干性和濕性兩種。干性是所有老年性黃斑變性患者最開始的狀態,在所有中期和晚期AMD中占比超過85%;濕性在疾病發展后期出現,通常導致嚴重的視力喪失。
Frost&Sullivan預計,中國濕性老年性黃斑變性的患病人數從2020年的376萬例增長至2025年的432萬例,對應的AMD抗VEGF藥物市場預計將從18億元增至56億元,CAGR達25.2%。
據東亞前海證券9月研報梳理,目前全球共有5款治療濕性年齡相關性黃斑變性的VEGF生物藥獲批,分別為美國諾華公司的雷珠單抗和布羅魯珠單抗、美國再生元和德國拜爾合作研發的阿柏西普、康弘藥業(SZ002773,股價16.20元,市值148.95億元)的康柏西普、羅氏公司的Faricimab,其中雷珠單抗、阿柏西普、康柏西普已在中國上市并進入醫保。
由于雷珠單抗和阿柏西普均于2020年專利到期,包括齊魯制藥、華東醫藥(SZ000963,股價41.48元,市值725.82億元)、泰恩康(SZ301263,股價27.85元,市值65.83億元)在內的國內多家制藥企業已經開始布局該類產品的仿制藥。
自主研發新藥的企業也不在少數,而從藥物設計看,現有的VEGF生物藥基本是單靶點,雙靶點結構的產品可以達到更好的治療效果。
在國內在研的生物創新藥中,榮昌生物(SH688331,股價54.25元,市值295.12億元)的核心產品之一RC18就是VEGF/FGF雙靶點融合蛋白,糖尿病性黃斑水腫和糖尿病視網膜病變臨床試驗進展到Ⅱ期;除了IBI333,信達生物還有兩款以VEGF為靶點的雙特異性抗體IBI302和IBI324正在開展臨床研究。
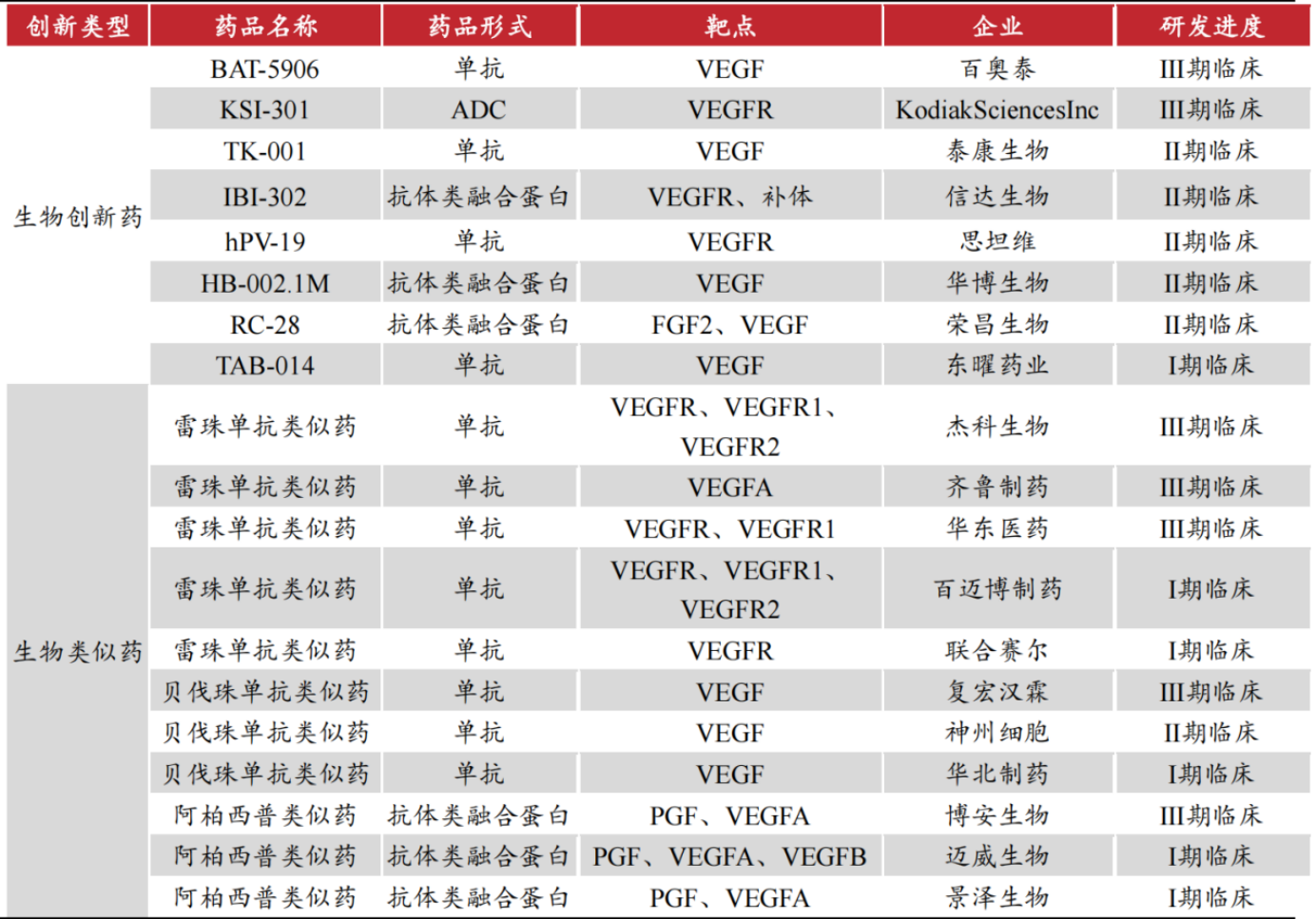
中國抗VEGF生物藥在研管線 圖片來源:東亞前海證券研報
公司點評:
PD-1類藥物是國內創新藥行業的熱點話題,當信達生物半年報發布后,市場首先想到的是比對公司22.4億元營收和-9.5億元歸母凈利潤在“PD-1四小龍(其余三家為百濟神州、恒瑞醫藥、君實生物)”中的排名,卻容易忽視眼科藥物在信達生物研發管線中的地位。
信達生物半年報顯示,公司有34個創新分子管線,其中25條為腫瘤管線產品,3個眼科產品在非腫瘤管線產品中占了三分之一,分別是IBI-302(靶點為VEGF/Complement)、IBI-324(靶點為VEGF/ANG2)、IBI-311(靶點為IGF-1R)。
IBI-302對應的新生血管性年齡相關性黃斑變性、高濃度治療新生血管性年齡相關性黃斑變性的2項適應癥已走到Ⅱ期臨床階段,IBI-324和IBI-311分別針對的糖尿病黃斑水腫和甲狀腺眼病則在Ⅰ期臨床階段。
值得注意的是,當前獲批的VEGF抑制劑均經患者玻璃體腔內注射給藥加之半衰期較短,給藥頻率較高(雷珠單抗一月給藥一次,康柏西普三月給藥一次),降低了患者的依從性。隨著今年8月羅氏的眼科雙抗Faricimab(靶向VEGF和ANG-2)在國內申請上市,更低的給藥頻率和理想的治療效果,很可能推動賽道重新洗牌。
未來,隨著抗VEGF藥物適應癥擴增、給藥方式突破單一的眼底注射方法、多靶點聯用、患者依從性和用藥接受度提高,抗VEGF藥物將會覆蓋更多的患者群體,市場有較大的提升空間。
而信達生物的IBI333作為全球首款獲批臨床的抗VEGF-A/VEGF-C雙抗,如果進展順利有望達成更多差異化優勢,在越發擁擠的腫瘤賽道之外貢獻臨床急需的眼科創新產品。
封面圖片來源:攝圖網-500720338
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
