每日經濟新聞 2022-12-15 23:32:12
◎12月14日,瑞科生物發布公告,宣布其新佐劑重組蛋白新冠疫苗ReCOV的菲律賓II期序貫加強臨床試驗取得積極結果。研究結果顯示,ReCOV序貫加強誘導的針對奧密克戎變異株BA.5和BA.2、原型株的真病毒中和抗體水平均顯著優于mRNA疫苗組(差異有統計學意義)。
◎12月15日,瑞科生物召開線上溝通會,公司創始人、董事長兼總經理劉勇表示ReCOV在安全性、有效性和可及性方面具有綜合優勢,目前公司已向中國監管部門滾動提交產品上市申請,產品的商業化準備正在積極進行中。
每經記者 林姿辰 每經編輯 楊夏
隨著防疫政策調整優化,國內防疫工作進入“下半場”,新冠疫苗作為預防新冠肺炎的主力武器,亟待升級換代。
12月14日,瑞科生物(HK02179,股價24.65港元,市值119.05億港元)發布公告,宣布其新佐劑重組蛋白新冠疫苗ReCOV的菲律賓II期序貫加強臨床試驗取得積極結果。研究結果顯示,ReCOV序貫加強誘導的針對奧密克戎變異株BA.5和BA.2、原型株的真病毒中和抗體水平均顯著優于mRNA疫苗組(差異有統計學意義)。
12月15日,瑞科生物召開線上溝通會,公司創始人、董事長兼總經理劉勇表示ReCOV在安全性、有效性和可及性方面具有綜合優勢,目前公司已向中國監管部門滾動提交產品上市申請,產品的商業化準備正在積極進行中。
未來,如何讓ReCOV在自費新冠疫苗市場上充分發揮優勢,也是公司正在積極準備的內容。
瑞科生物公告顯示,該II期研究共入組受試者600例,所有受試者均完成2劑滅活疫苗基礎免疫,按照隨機分組分別采用ReCOV疫苗或對照疫苗輝瑞mRNA疫苗(COMIRNATY)進行序貫加強接種,以比較ReCOV與mRNA疫苗加強免疫的免疫原性和安全性。
研究結果顯示,在針對原型株、奧密克戎變異株BA.2和奧密克戎變異株BA.5的臨床研究中,ReCOV疫苗的中和抗體水平均明顯優于mRNA疫苗;在針對近期廣泛流行于北京地區的BA.5變異株的研究中,研究接種14天時,ReCOV組、mRNA疫苗組針對奧密克戎變異株BA.5中和抗體的陽轉率(SCR)分別為92.1%及88.4%,中和抗體GMT分別為4387.4及3100.6,ReCOV組均顯著高于mRNA疫苗組。
此外,ReCOV組誘導的中和抗體較基線升高22.47倍,明顯高于mRNA疫苗(15.89倍)。ReCOV組針對奧密克戎變異株BA.5的中和抗體較原型株僅下降1.77倍,顯示出交叉中和作用。
同時,研究還證明ReCOV的總體安全性良好。截至數據分析日,接種ReCOV的受試者均未報告SAE(嚴重不良事件)或導致提前退出研究的TEAE(治療相關的不良事件),也未報告有臨床意義的生命體征或臨床實驗室檢查異常。
“從產品的穩定性上來講,ReCOV在室溫下存放至少6個月,在2-8度的情況下至少存放24個月,都可以高度穩定,仍然符合質量標準。所以在有效性、安全性、可及性上,ReCOV都有獨特優勢。”
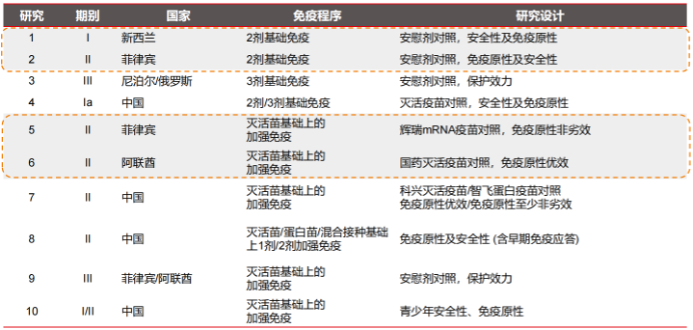
瑞科生物首席醫學官張建慧表示,目前公司已對ReCOV制定了至少10項境內外臨床開發計劃,部分已經完成或者正在結尾。其中,4項臨床試驗針對基礎免疫展開,6項臨床試驗針對加強免疫展開。
值得注意的是,公司在阿聯酋開展的滅活疫苗基礎上的加強免疫臨床試驗以國藥滅活疫苗作為對照;公司在國內準備啟動兩項加強免疫基礎上的II期臨床研究,其中一項分別以科興的滅活疫苗和智飛的蛋白疫苗作為對照組研究,另外一項則是在不同的基礎免疫人群里進行的1劑或者2劑加強免疫研究。
圖片來源:受訪者提供
12月13日,國務院應對新型冠狀病毒肺炎疫情聯防聯控機制綜合組下發《新冠病毒疫苗第二劑次加強免疫接種實施方案》(簡稱“《方案》”)。《方案》稱,所有批準附條件上市或緊急使用的疫苗均可用于第二劑次加強免疫。優先考慮序貫加強免疫接種,或采用含奧密克戎毒株或對奧密克戎毒株具有良好交叉免疫的疫苗進行第二劑次加強免疫接種。

第二劑次加強免疫接種組合 圖片來源:國家衛健委截圖
從技術路線和涵蓋的毒株看,以ReCOV為代表的大多數在研新冠疫苗,理論上能夠滿足當前市場需求;但從市場格局看,它們要面臨激烈的市場競爭。
據國聯證券12月研報統計,自今年9月份以來,NMPA(國家藥品監督管理局)已批準了6家廠商新冠疫苗的緊急使用,分別為麗珠集團(SZ000513,股價35.15元,市值328.85億元)、神州細胞(SH688520,股價67.20元,市值299.27億元)、三葉草生物(HK02197,股價3.24港元,市值41.88億港元)、四川大學華西醫院研發的4款重組蛋白疫苗,康希諾(SH688185,股價195.41元,市值483.54億元)的吸入型腺病毒載體疫苗,萬泰生物(SH603392,股價134.05元,市值1214.59億元)的鼻噴流感病毒載體疫苗。
其中,萬泰生物針對的人群最為廣泛,適用于18歲以上,未免疫任何新冠疫苗人群,以及既往已接種過1針、2針或3針其他新冠疫苗的人群。
從臨床數據上看,萬泰生物的有效性更為優異,重癥保護率為100%,60歲以上人群保護效力不弱于18-59歲人群,并且終點病例基因分型均為奧密克戎株;從針對奧密克戎株的中和抗體水平來看,神州細胞和康希諾(吸入)更為優異,其中神州細胞的新冠疫苗為針對Alpha/Beta變異株的二價疫苗;康希諾的吸入劑型,與萬泰生物的鼻噴劑型都能誘導人體的黏膜免疫,在防感染保護力上更優。
這些具有差異化優勢的新冠疫苗是ReCOV的直接競爭對手,而ReCOV疫苗大概率會是瑞科生物首款商業上市的產品。
劉勇表示,目前公司正在緊張地進行產品上市方案的修訂工作,其中包括如何在政府采購市場進行產品的準入和推廣,也包括如何進行價格談判等。
在生產上,此前公司設計的疫苗年產能在2億劑以上。按照一般產品的上市規律,通常需要3-6個月時間可以達到滿產的狀態,如果未來產品順利獲批使用,公司將盡量縮短產能爬坡時間。
另外,考慮到未來新冠肺炎的傳染病管理級別可能從“乙類甲管”回歸到“乙類乙管”,新冠疫苗產品將相應產生相當規模的自費苗市場,如何讓ReCOV在自費新冠疫苗市場上充分發揮優勢,也是瑞科生物正在積極準備的內容。
封面圖片來源:攝圖網-500520040
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
