每日經濟新聞 2023-02-17 00:17:11
◎2021年,諾誠健華與渤健就有望治療多發(fā)性硬化癥的奧布替尼的全球開發(fā)和商業(yè)化,達成合作和許可協(xié)議。
◎日前,諾誠健華公告,近日接渤健通知,決定為便利而終止雙方此前達成的合作和許可協(xié)議,公司將重獲許可協(xié)議項下授予渤健的所有全球權利。
◎對于市場上關于該產品被“退貨”的說法,諾誠健華方面予以否認,并對奧布替尼展示出較高的信心。公司表示相關試驗二期數據將在90天之后公布,本次協(xié)議終止不會影響首付款及其他相關已確認收入。
每經記者 林姿辰 每經編輯 文多
2月16日,國內第一梯隊創(chuàng)新藥企業(yè)諾誠健華(SH688428,股價12.44元,市值219億元)開盤下行,截至收盤,跌幅18.37%。
消息面上,前一日盤后,公司發(fā)布公告,近日,Biogen Inc.(以下簡稱“渤健”,BIIB,股價270.621美元,市值389.70億美元)通知公司,決定為便利而終止(Terminate for Convenience)雙方此前達成的合作和許可協(xié)議(指奧布替尼的全球開發(fā)和商業(yè)化),公司將重獲許可協(xié)議項下授予渤健的所有全球權利。
對于市場上關于該產品被“退貨”的說法,諾誠健華方面接受《每日經濟新聞》記者采訪時予以否認,并對奧布替尼展示出較高的信心。公司表示相關試驗二期數據將在90天之后公布,本次協(xié)議終止不會影響首付款及其他相關已確認收入,雙方均不會對此次協(xié)議終止支付違約金。
但在拋售股票的投資者眼里,雙方終止合作的原因不明意味著不確定性。“肝損傷”風險、同類產品競爭日益復雜,都是奧布替尼需要跨過的障礙。
二級市場對于消息的強烈反應,與奧布替尼的意義不無關聯(lián)。
對于行業(yè),這款于2020年12月附條件獲批的抗腫瘤藥物,是第二款獲批的國產BTK抑制劑,可用于治療成人套細胞淋巴瘤(MCL),以及成人慢性淋巴細胞白血病(CLL)/小淋巴細胞淋巴瘤(SLL)。
圖片來源:公司公告截圖
在2022年末,公司旗下CD19單抗藥物在中國香港獲批上市之前,奧布替尼是諾誠健華唯一一款商業(yè)化產品,上市銷售半年多收到了全球MS(多發(fā)性硬化癥)龍頭渤健拋去的橄欖枝,成為公司首款license out(授權合作)的產品。
2021年7月,諾誠健華與渤健就有望治療MS和其他自身免疫性疾病的口服小分子BTK抑制劑奧布替尼的全球開發(fā)和商業(yè)化達成合作和許可協(xié)議,約定公司將奧布替尼在MS領域的全球獨家權利、除中國以外區(qū)域內的某些自身免疫性疾病領域的獨家權利授予渤健。
根據協(xié)議約定,渤健向諾誠健華一次性支付不可退還和不予抵扣的首付款1.25億美元,并且最高還將有8.125億美元的銷售里程碑付款。
這項合作只維持了約一年半的時間。2月15日,諾誠健華發(fā)布公告稱,渤健決定為便利而終止(Terminate for Convenience)雙方此前達成的合作和許可協(xié)議。公司將重獲協(xié)議項下授予渤健的所有全球權利,包括相關知識產權、研發(fā)決策權、生產和商業(yè)化權益,以及源自奧布替尼的商業(yè)收益。雙方將在90天內完成權益過渡。
2月16日,諾誠健華方面對《每日經濟新聞》記者表示,Terminate for Convenience是個法律術語,可以被視為自由解除,沒有理由(Terminate without Reasons)。這是之前合同里提到的,不需要出現任何情況觸及。雙方均不會對此次協(xié)議終止支付違約金,協(xié)議終止也不會影響公司收到的首付款及其他相關已確認收入。
不過,大量投資者還是急忙出逃。截至16日收盤,諾誠健華當天在A股和港股的股價分別下跌18.37%和27.34%。
投資者的悲觀情緒或源于兩個方面,一是雙方合作破裂原因未知,超8億美元的銷售里程碑是否實實在在打水漂了;二是奧布替尼針對MS的開發(fā),此前就已在美國碰壁。
2022年12月23日,諾誠健華曾公告稱,美國食品藥品監(jiān)督管理局(FDA)已對奧布替尼用于治療多發(fā)性硬化癥實施部分臨床擱置。理由是入組患者出現肝損傷。
在美國進行的二期研究將不會開展新的患者招募,受試者如使用奧布替尼70天或更短將中止用藥,完成超過70天研究的受試者則獲準繼續(xù)使用奧布替尼。美國以外地區(qū)的臨床招募將暫停。
公告發(fā)布不久,諾誠健華BTK抑制劑遭渤健所謂“退貨”的消息在市場中迅速傳播,但在與《每日經濟新聞》記者交流時,公司方面稱這種說法并不恰當,并表示目前的二期臨床試驗處于雙盲階段,第三方數據機構正在分析研究,“渤健因為二期臨床試驗數據不佳終止合作”的說法完全沒有根據。
“這次與渤健的合作終止,有猜測是因為相關二期臨床試驗被hold(暫停);但其實,雙方都沒有這樣說過。”公司方面人士表示。
在力挺諾誠健華的投資者眼中,渤健和諾誠健華的“和平分手”有另一個版本,即因重磅藥物專利到期陷入困頓的渤健,是雙方合作終止的主要責任人。
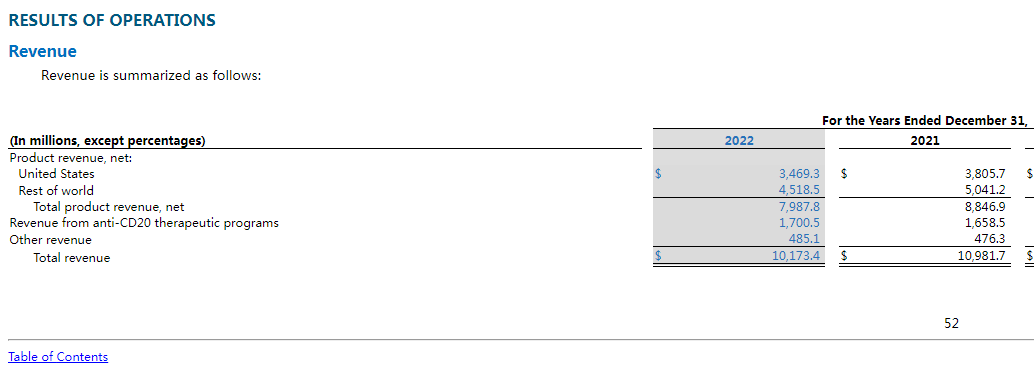
根據2月15日渤健公布的2022年財報,公司全年總營收101.73億美元,同比下降7.4%,凈利潤29.62億美元,同比增長71.43%,研發(fā)投入22.31億美元,同比下降10.8%。
圖片來源:渤健年報截圖
公司收入降低而凈利潤高速增長的原因,主要包括出售三星Bioepis公司全部股權所得的10億美元現金(總交易金額為23億美元)等。
從產品看,渤健針對MS治療的重磅藥物Tecfidera營收為14.44億美元,同比下降26%;針對髓性肌萎縮癥的諾西那生鈉營收為17.94億美元,同比下降5.9%。
據報道,在電話會議中,渤健明確表示會專注于重新調整公司的方向,將重心放在產品銷售額增長上,著眼于成本。具體來說,公司將根據項目的成功概率、所需成本,來重排藥物研發(fā)的優(yōu)先級,將資源重點放在那些在各自治療領域具有變革性的產品上,比如阿爾茨海默癥藥物Leqembi和口服抑郁癥新藥zuranolone。
諾誠健華還對奧布替尼積極表態(tài),試圖給支持公司的投資者打一劑強心針。公司方面稱:“歡迎奧布替尼重回公司的自身免疫性疾病管線。奧布替尼治療MS的II期臨床研究仍在進行中,預計2023年第二季度公布中期分析結果。”此外,“公司已在國際頂尖學術會議EULAR以重磅口頭報告了奧布替尼治療系統(tǒng)性紅斑狼瘡II期臨床試驗所取得的積極效果,公司堅信奧布替尼在中樞神經系統(tǒng)的血腦穿透屏障(BBB)能力,具備抑制B細胞和髓樣細胞功能的潛力,有望為所有MS亞型以及其他自身免疫性疾病進展提供有益的臨床價值”。
作為一種酶,BTK抑制劑在不同類型的惡性血液病中廣泛表達,所以在適應癥方面有較大探索空間。截至目前,全球監(jiān)管機構已批準5款BTK抑制劑,除了奧布替尼,還包括1款國產產品、3款進口產品,分別是伊布替尼(強生/艾伯維)、阿卡替尼(阿斯利康/安斯泰來)、澤布替尼(百濟神州)、奧布替尼(諾誠健華)、Tirabrutinib(吉利德/小野藥品)。
根據諾誠健華2022年中報,公司有14項奧布替尼適應癥在研,除了10項布局在血液瘤領域,還有4項布局在自身免疫性疾病領域,其中包括MS。

圖片來源:諾誠健華半年報截圖
但從適應癥看,目前獲批的BTK抑制劑多被批準用于治療復發(fā)/難治性套細胞淋巴瘤(MCL)、復發(fā)/難治性慢性淋巴細胞白血病/小淋巴細胞淋巴瘤(CLL/SLL)、復發(fā)/難治性華氏巨球蛋白血癥(WM)等血液腫瘤,僅伊布替尼被批準用于治療慢性移植物抗宿主病(cGVHD)。
換言之,目前還沒有BTK抑制劑在自身免疫性疾病領域成藥。而在MS領域,BTK抑制劑與肝損傷問題共同出現并非首次。
2022年10月,德國默克Evobrutinib治療MS的Ⅱ期臨床數據顯示,治療組中轉氨酶升高的患者比例達26%,表明Evobrutinib存在較高的肝損傷風險;
2022年6月,FDA暫停了賽諾菲Tolebrutinib在MS、重癥肌無力方面開展的3期臨床試驗,原因是出現多例藥物引發(fā)的肝損傷。不過經過臨床調整后,Tolebrutinib治療多發(fā)性硬化癥的臨床試驗之后得以繼續(xù)招募患者。
整體來看,肝損傷沒有堵死BTK抑制劑在MS領域的探索之路,但的確是奧布替尼需要解決的挑戰(zhàn)。
對此,諾誠健華方面稱,多發(fā)性硬化這種疾病似乎對肝臟非常敏感,目前獲批MS的藥物中絕大多數都有肝功能相關的問題。奧布替尼實驗中,受影響患者極少,時間主要發(fā)生在前兩個月,不過停藥可逆。因此需要加強患者轉氨酶監(jiān)測頻率,加以預防。奧布替尼在全球Ⅱ期臨床試驗入組已經基本完成,除去被要求中止用藥的患者,有140多名患者可以正常進行數據分析。
對于該項目未來的走向,諾誠健華方面對記者表示,公司90日過渡后重新接手,不再繼續(xù)患者入組,而是盡快完成揭盲和數據發(fā)布。如果數據比較好,無論是自主承擔費用,還是在國際市場尋找商業(yè)化合作伙伴,公司都會積極推進III期實驗;未來公司在自免管線的綜合布局上將有更多主動性和靈活性,例如授權合作可以基于適應癥劃分全球權利;也可能根據地理區(qū)域,劃分全球權利。
封面圖片來源:視覺中國
如需轉載請與《每日經濟新聞》報社聯(lián)系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯(lián)系索取稿酬。如您不希望作品出現在本站,可聯(lián)系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
