每日經濟新聞 2023-03-29 20:53:06
◎腫瘤領域藥物是阿斯利康最主要的收入來源,2022全年實現營收155.39億美元,同比增長15%,占總營收的比重為35%。除了在國內最新獲批的阿布替尼外,阿斯利康與第一三共合作開發的明星ADC藥物DS8201今年2月也在國內獲批上市。
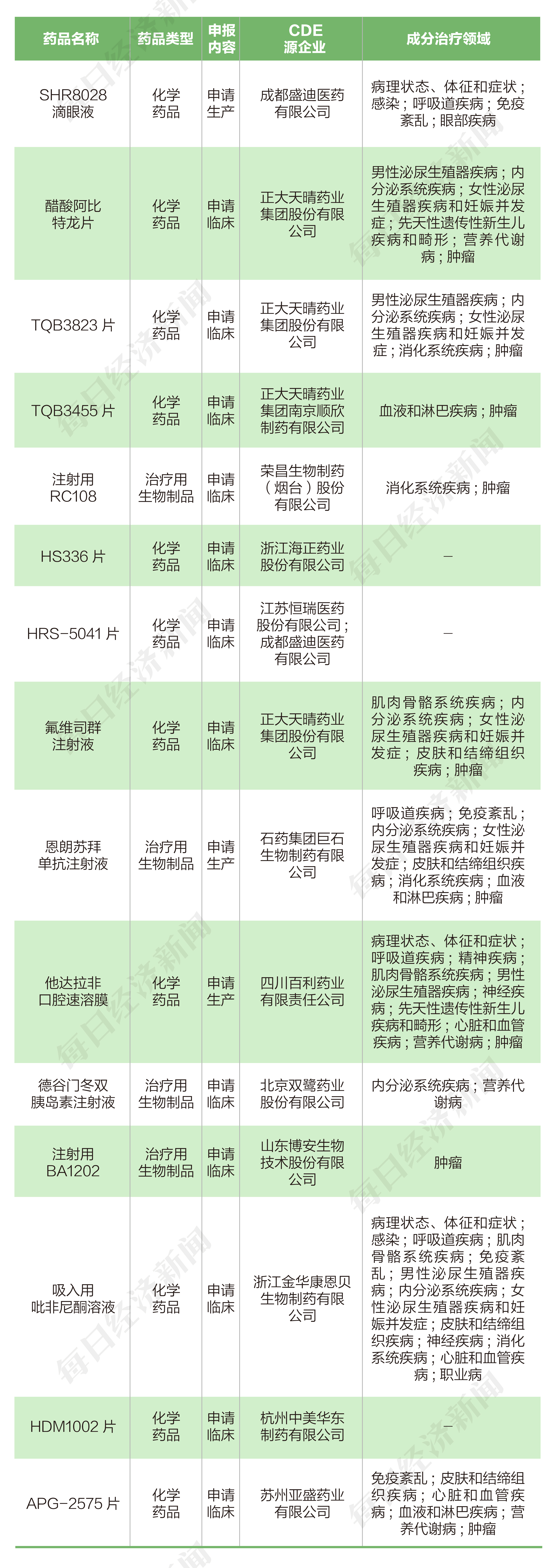
◎華東醫藥子公司中美華東制藥提交的1類化藥新藥HDM1002片臨床試驗申請已經獲受理。HDM1002是華東醫藥自主研發的小分子GLP-1(胰高血糖素樣肽1)受體激動劑,GLP-1是非胰島素類降糖藥開發的三大熱門靶點之一,全球糖尿病藥物巨頭如諾和諾德、禮來、賽諾菲、阿斯利康等,紛紛有所布局。
每經記者 陳星 每經編輯 魏官紅

《掘金創新藥》由每日經濟新聞聯合藥渡數據共同推出,旨在解讀新藥研發進展與趨勢,剖析產品競爭力與市場前景,洞察醫藥資本脈絡,見證醫藥產業高質量發展。
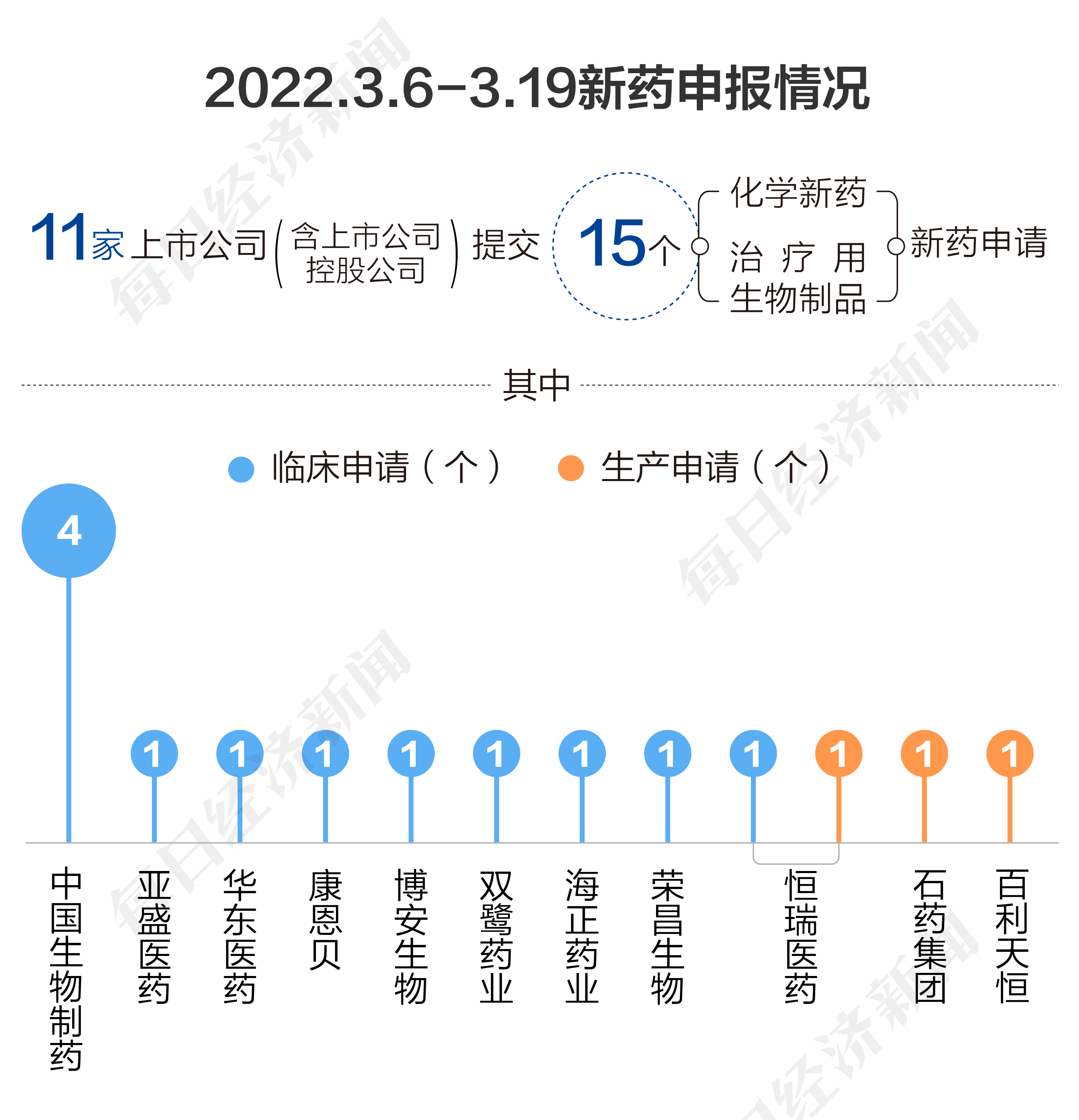
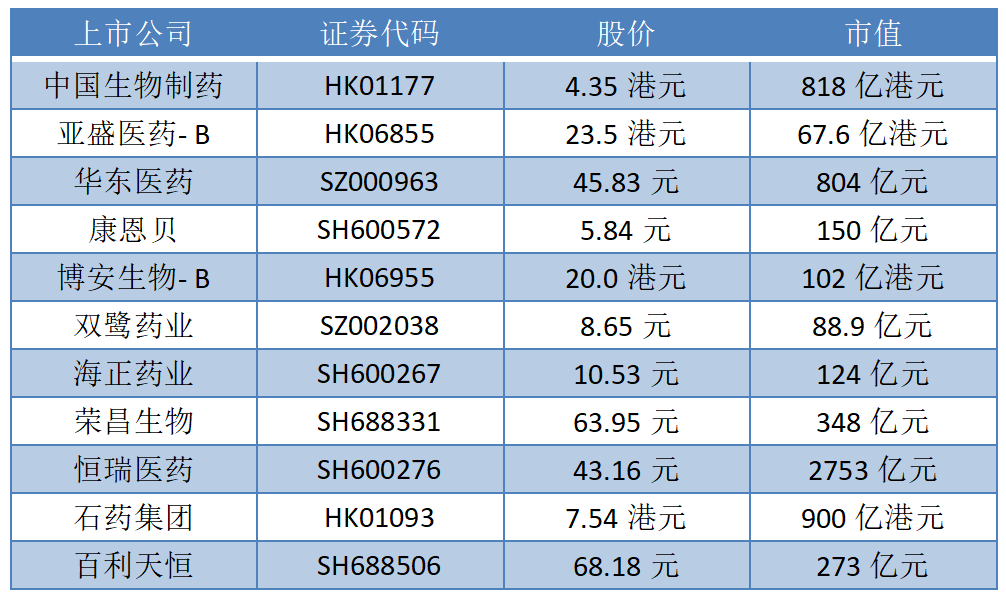
根據藥渡數據,2023年3月6日至3月19日,國家藥品監督管理局藥品審評中心(CDE)共收到11家上市公司(含上市公司控股公司)提交的15個化學新藥、治療用生物制品新藥申請。
2023年3月6日至3月19日期間,上市公司方面,中國生物制藥提交4個臨床申請,恒瑞醫藥提交1個臨床申請和1個生產申請。
榮昌生物、海正藥業、雙鷺藥業、博安生物、康恩貝、華東醫藥、亞盛醫藥分別提交1個臨床申請。石藥集團、百利天恒各提交1個上市申請。
1.阿斯利康首款血液腫瘤藥物在華獲批上市 國內BTK抑制劑增至4款
3月23日,阿斯利康宣布康可期®(英文商品名:CALQUENCE®,通用名:阿可替尼膠囊)已獲得中國國家藥品監督管理局的附條件批準上市,用于既往至少接受過一種治療的成人套細胞淋巴瘤(MCL)患者。新一代高選擇性布魯頓氏酪氨酸激酶(BTK)抑制劑阿可替尼是阿斯利康在中國獲批的首款血液腫瘤治療藥物。
此前,阿可替尼已在美國被批準用于治療慢性淋巴細胞白血病(CLL)和小淋巴細胞淋巴瘤(SLL)。
行業洞察:
非霍奇金淋巴瘤(NHL)發病率約占所有淋巴瘤的87%。非霍奇金淋巴瘤(NHL)患者中,占比最多的是彌漫大B細胞淋巴瘤(DLBCL)患者。
套細胞淋巴瘤(MCL)則是一種少見的非霍奇金淋巴瘤,臨床上通常具有侵襲性,占中國所有非霍奇金淋巴瘤病例的2%-6%,確診的患者年齡通常在60歲左右,且確診時通常已是疾病晚期。由于患者多數為老年人,不能耐受傳統化療的毒性,且盡管MCL患者對初始治療敏感,但復發率很高,因此BTK抑制劑已成為MCL二線及以后治療的首選方案。
目前全球范圍內共批準6款BTK抑制劑上市,分別是伊布替尼(2013年,強生/艾伯維)、阿可替尼(2017年,阿斯利康)、澤布替尼(2019年,百濟神州)、tirabrutinib(2020年,吉利德/Ono)、奧布替尼(2020年,諾誠健華),pirtobrutinib(禮來,2023年)。
在國內,阿可替尼是第四款上市的BTK抑制劑,此前上市的有伊布替尼、澤布替尼和奧布替尼。
作為首個初代BTK抑制劑,伊布替尼的先發優勢較為明顯,并在2021年達到全球銷售額的頂峰97.77億美元。然而,在二代BTK抑制劑先后上市的攪動下,2022年伊布替尼的銷售收入首次出現下滑。在國內,隨著競爭對手的增加,伊布替尼的市場份額也有所下滑。
澤布替尼則是由國內藥企百濟神州自主研發的BTK抑制劑。根據百濟神州2022年年報,澤布替尼全球銷售額達38.29億元,同比增幅達159%。在美國的銷售額為26.44億元,在中國實現銷售額10.15億元,美國市場占澤布替尼全球銷售額約七成。
根據德意志銀行報告,2022年BTK全球市場規模約為84億美元,而到2026年,這一市場規模預計將增加至204億美元。隨著此次阿可替尼在國內獲批,BTK抑制劑市場格局有望再度發生變化。
公司點評:
去年阿斯利康全年營收443.51億美元,同比增長19%(按固定匯率計算增長25%)。研發支出97.62億美元,同比增長5%。
腫瘤領域藥物是阿斯利康最主要的收入來源,2022全年實現營收155.39億美元,同比增長15%,占總營收的比重為35%。
在腫瘤領域中阿斯利康有4款產品,去年銷售額超過20億美元。分別是奧希替尼,同比增長9%至54.44億美元;PD-L1度伐利尤單抗,銷售額同比增長15%至27.84億美元;PARP抑制劑奧拉帕利,銷售額同比增長12%至26.38億美元;BTK抑制劑阿可替尼增速最快,同比增長66%,達20.57億美元。
在中國市場,去年阿斯利康收入為57.92億美元(-4%),占阿斯利康在新興市場收入的49.3%。阿斯利康預計新的一年中國區將重新增長,預計增長低個位數百分比。除了在國內最新獲批的阿布替尼外,阿斯利康與第一三共合作開發的明星ADC藥物DS8201今年2月也在國內獲批上市。僅用了3年時間,DS8201在疫情影響下年銷售額仍成功突破了10億美元,國內獲批后或給阿斯利康新的業績利好。
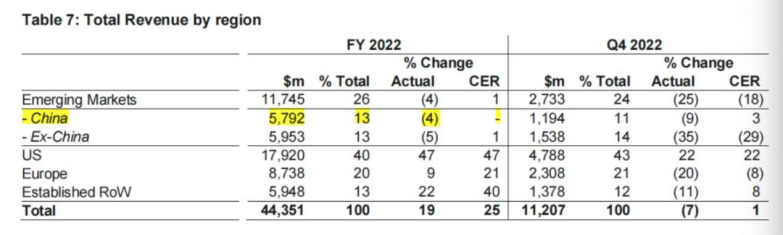
圖片來源:財報截圖
2.華東醫藥降糖新藥申報臨床 搶灘GLP-1受體激動劑市場
3月10日,國家藥監局藥品審評中心(CDE)顯示,華東醫藥子公司中美華東制藥提交的1類化藥新藥HDM1002片臨床試驗申請已經獲受理。HDM1002是華東醫藥自主研發的小分子GLP-1(胰高血糖素樣肽1)受體激動劑,并擁有全球自主知識產權。
行業洞察:
GLP-1是非胰島素類降糖藥開發的三大熱門靶點之一,全球糖尿病藥物巨頭如諾和諾德、禮來、賽諾菲、阿斯利康等,紛紛有所布局,并已有司美格魯肽、利拉魯肽、度拉糖肽等多個GLP-1受體激動劑上市。
廣發證券研報顯示,2022年,GLP-1市場規模超過200億美元,超過胰島素并在降糖與減重兩大領域不斷挖潛。以諾和諾德為例,其2022年GLP-1受體激動劑收入超過胰島素。GLP-1業務全年收入833.71億丹麥克朗(約合118.12億美元)同比增長56%。其中,司美格魯肽銷售額為597.5億丹麥克朗(約合84.65億美元),同比增長77%,口服制劑Rybelsus銷售額為112.99億丹麥克朗(約合16.00億美元)同比增長134%,二者合計貢獻710.49億丹麥克朗(約合100.65億美元)。
國金證券今年2月發布的研報顯示,國內已有8款GLP-1受體激動劑獲批上市,4款為短效注射劑,分別是艾塞那肽、利拉魯肽、貝那魯肽和利司那肽;另4款為長效注射劑,分別為艾塞那肽微球、度拉糖肽、洛塞那肽和司美格魯肽。
公司點評:
在GLP-1受體激動劑上,華東醫藥布局多款在研產品,公司GLP-1靶點在研產品包括小分子、多肽及融合蛋白。其中HDM1002、TTP273為口服小分子GLP-1受體激動劑;利拉魯肽、司美格魯肽屬于多肽類GLP-1受體激動劑;此外,SCO-094及其衍生物為GLP-1和GIP雙靶點激動劑;DR10624為同時靶向GLP-1受體(GLP-1R)、GCG受體(GCGR)和FGFR1c/Klothoβ(FGF21R)的Fc融合蛋白藥物。
利拉魯肽中國專利已經到期,中美華東、翰宇醫藥、通化東寶等6家企業均已提交利拉魯肽生物類似藥的上市申請。其中,華東醫藥是國內首個提交糖尿病適應癥上市申請的國產利拉魯肽,有望率先獲批上市;其減肥適應癥的上市申請也于2022年7月獲CDE受理。
但今年3月,CDE官網顯示,中美華東提交的人胰高血糖素樣肽-1(GLP-1)受體激動劑利拉魯肽注射液用于肥胖或超重適應癥的上市許可申請被暫停,受理號分別為CXSS2200065和CXSS2200064的上市申請狀態顯示為“暫停”。華東醫藥方面對此回應稱,公司利拉魯肽注射液減肥適應癥的審評因需要補充單項資料而暫停,為審評正常流程。
另一款GLP-1受體激動劑的代表藥物——司美格魯肽,原研藥由諾和諾德研發,注射劑型已經于2021年4月在國內獲批上市,在中國的專利期將于2026年到期,國內僅有原研藥獲批上市;諾和諾德的口服司美格魯肽片也已經在國內遞交上市申請。
2021年6月,華東醫藥率先發起司美格魯肽專利挑戰,遞交司美格魯肽CN101133082B的專利無效申請。國家知識產權局作出審查決定,宣告諾和諾德的專利權全部無效,諾和諾德已經就國家知識產權局的這一決定上訴至北京知識產權法院,雙方專利戰進入拉鋸階段。
封面圖片來源:每日經濟新聞 資料圖
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
