每日經濟新聞 2023-04-21 22:51:02
◎君實生物方面回應《掘金創新藥》研究員稱,FLAMES研究的期中分析結果表明,senaparib可顯著延長晚期卵巢癌患者的無進展生存期(PFS),且不論患者的乳腺癌易感基因(BRCA)表達如何,患者均可獲益。
◎研究員認為,CAR-T產品自獲批以來,其可及性問題一直備受關注,各家藥企在提高工藝、降低成本的同時,也在積極推進CAR-T產品向血液瘤以外領域的突破。從這一點上而言,藥明巨諾與復星醫藥在自免領域的探索不謀而合。
每經記者 許立波 每經編輯 魏官紅

《掘金創新藥》由每日經濟新聞聯合藥渡數據共同推出,旨在解讀新藥研發進展與趨勢,剖析產品競爭力與市場前景,洞察醫藥資本脈絡,見證醫藥產業高質量發展。
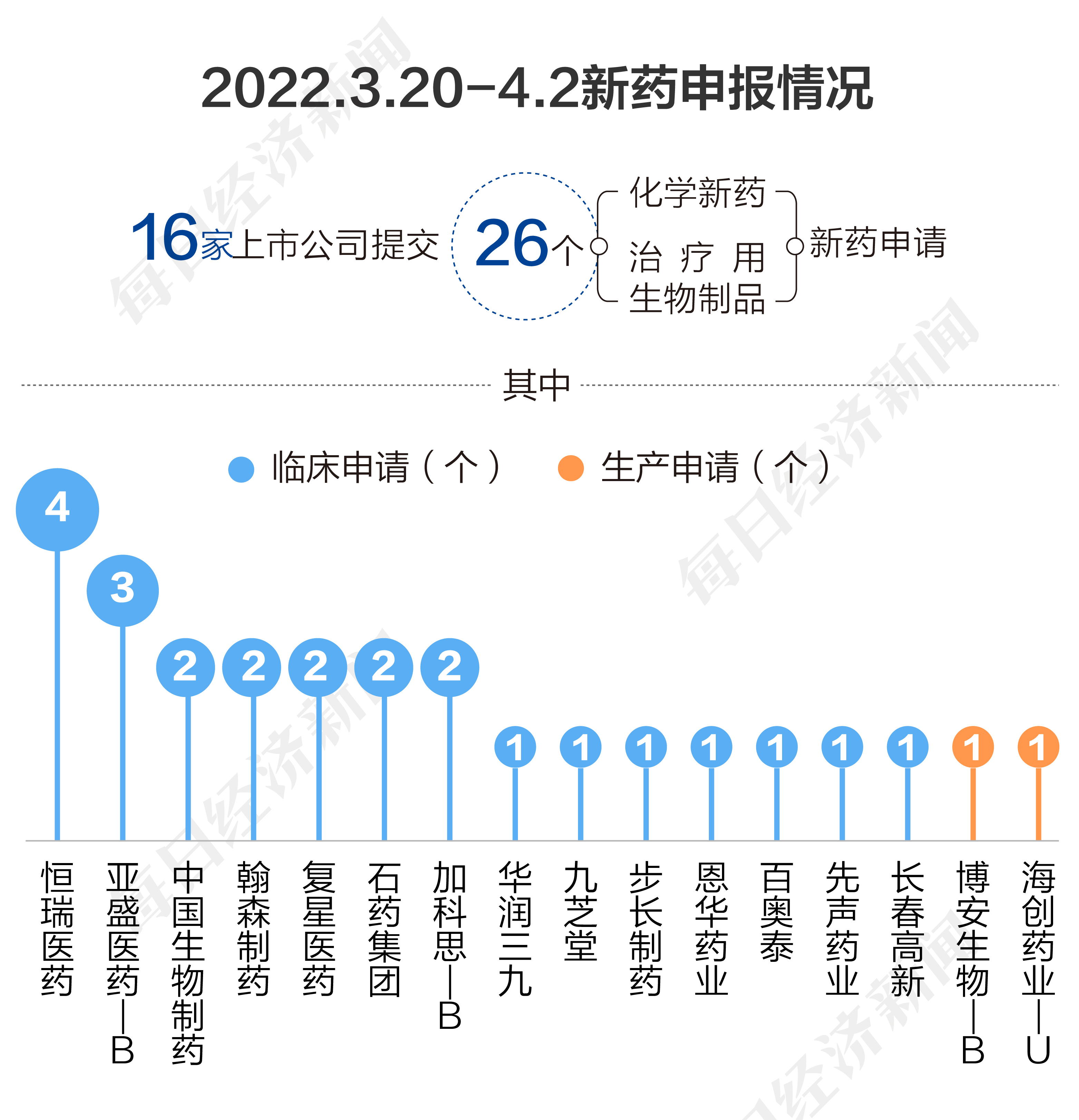
根據藥渡數據,2023年3月20日至4月2日,國家藥品監督管理局藥品審評中心(CDE)共收到16家上市公司提交的26個化學新藥、治療用生物制品新藥申請。
2023年3月20日至4月2日期間,上市公司方面,恒瑞醫藥提交4個臨床申請;亞盛醫藥-B提交3個臨床申請;加科思-B、石藥集團、復星醫藥、翰森制藥、中國生物制藥各提交2個臨床申請;長春高新、先聲藥業、百奧泰、恩華藥業、步長制藥、九芝堂、華潤三九各提交1個臨床申請。海創藥業-U、博安生物-B各提交1個生產申請。
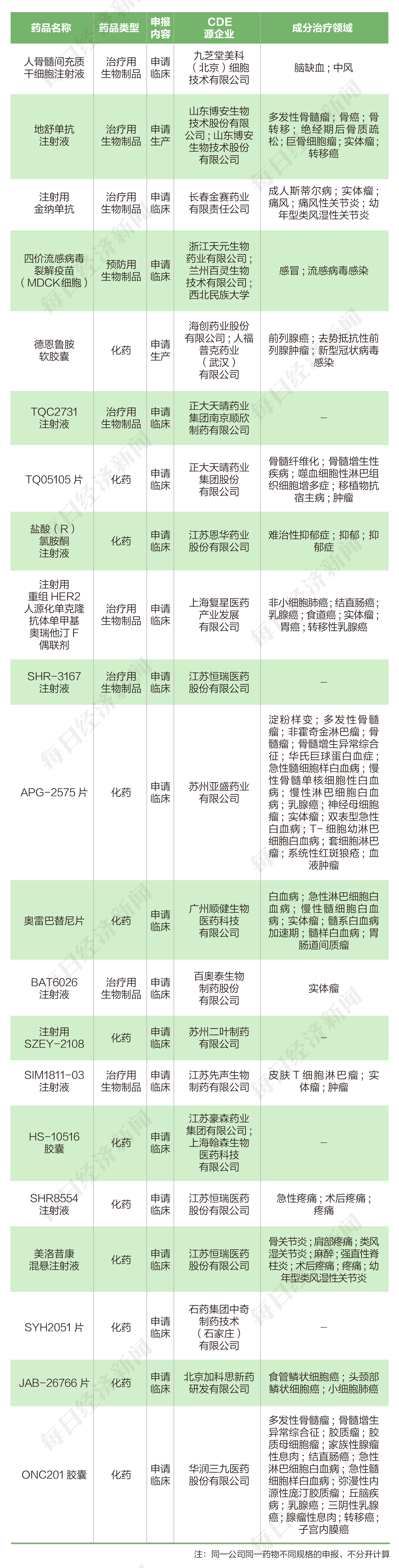
1、君實生物PARP抑制劑III期臨床達到主要研究終點
2023年4月11日,君實生物公告稱,公司與英派藥業合作開發的聚腺苷二磷酸核糖聚合酶(PARP)抑制劑senaparib(產品代號:JS109/IMP4297)用于國際婦產科聯盟(FIGO)Ⅲ-Ⅳ期上皮性卵巢癌、輸卵管癌或原發性腹膜癌患者,對一線含鉑化療達到完全或部分緩解后維持治療的隨機、雙盲、安慰劑對照、多中心III期臨床研究(FLAMES研究,NCT04169997)已完成方案預設的期中分析。獨立數據監查委員會(IDMC)判定研究的主要終點達到方案預設的優效界值。公司與英派藥業將于近期與監管部門溝通遞交該藥品的新藥上市申請事宜。
FLAMES研究是一項隨機、雙盲、安慰劑對照、多中心的III期臨床研究,也是首個獲得陽性結果的國產PARP抑制劑用于卵巢癌一線維持治療III期臨床研究。該研究旨在評價一線含鉑化療達到完全緩解(CR)或部分緩解(PR)后senaparib單藥維持治療FIGO III/IV期卵巢癌患者的有效性和安全性。
君實生物方面回應《掘金創新藥》研究員稱,FLAMES研究的期中分析結果表明,senaparib可顯著延長晚期卵巢癌患者的無進展生存期(PFS),且不論患者的乳腺癌易感基因(BRCA)表達如何,患者均可獲益。此外,君實生物方面還透露,該臨床研究的詳細數據將在今年下半年的學術會議上進行公布。
行業洞察:
卵巢癌是最常見的致死性女性生殖道惡性腫瘤之一。根據GLOBOCAN 2020數據,全球卵巢癌的年新發病例數約31萬,每年死亡病例數約21萬。由于卵巢癌早期癥狀隱匿且非特異,約80%的患者確診時已為晚期,5年生存率僅有40%。
盡管卵巢癌經過初始含鉑化療后可以得到緩解,但大多數患者可能面臨復發。近年來,PARP抑制劑正在改變卵巢癌的治療格局,其維持治療可延長一線含鉑化療后的緩解時間,延緩復發。
據弗若斯特沙利文報告,全球范圍內PARP抑制劑市場增長迅速,2020年達到24億美元,預計未來市場規模將以38.3%的復合年增長率增長,2025年達到123億美元。在中國PARP抑制劑市場,預計將于2025年增長到約人民幣147億元。
從市場格局來看,據西南證券研報的梳理,截至2022年2月,全球范圍內共批準6款PARP抑制劑獲批上市,其中,中國獲批的有4款,分別是阿斯利康的奧拉帕利(2018年)、再鼎醫藥從GSK子公司Tesaro處引進的尼拉帕利(2019年)、恒瑞醫藥和豪森藥業聯合開發的氟唑帕利(2020年)以及百濟神州的帕米帕利(2021年)。
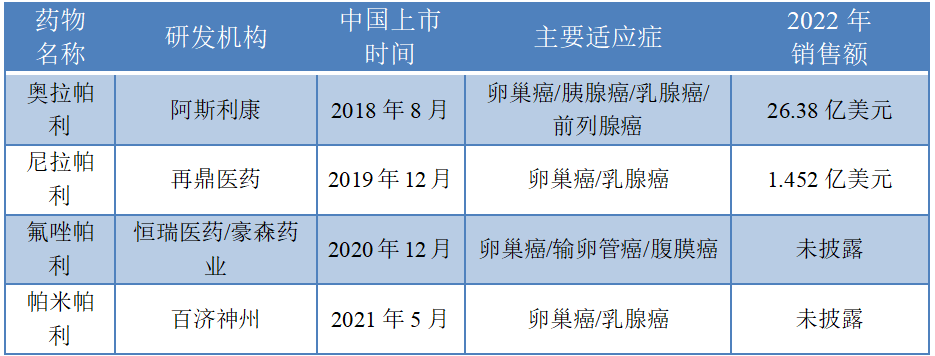
數據來源:據公開資料、企業年報等整理
2014年,全球首個PARP抑制劑奧拉帕利獲批上市,伴隨著多項適應癥的獲批,其銷售額呈持續上升趨勢。西南證券研報顯示,在上市的PARP抑制劑中,奧拉帕利獲批適應癥最多,分別獲批了輸卵管癌、卵巢癌、腹膜癌、胰腺癌、乳腺癌、前列腺癌。2022年,奧拉帕利的全球銷售額繼續攀升,達到26.38億美元(同比增長12%);其國內銷售數據雖未明確披露,但根據米內網數據,2021年奧拉帕利中國市場醫院終端+零售終端銷售收入約為11.63億元。
4月1日,據CDE官網,輝瑞甲苯磺酸他拉唑帕利膠囊遞交上市申請已受理,他拉唑帕利是全球第4款(共6款)獲批上市的PARP抑制劑,也是國內第5款申報上市的PARP抑制劑,其進度已領先君實生物一步。
《掘金創新藥》研究員分析認為,目前國內PARP抑制劑競爭格局尚屬良好,雖然阿斯利康的奧拉帕利占據先發優勢,其余幾家的PARP抑制劑在獲批適應癥數量、臨床進展等方面暫難以與之抗衡,但考慮到再鼎醫藥的尼拉帕利在上市后銷售額也在2021年(9357.9萬美元)、2022年(1.452億美元)呈現爆發式增長,這一成績幾乎與先一步在國內上市的奧拉帕利相差無幾,或說明PARP抑制劑仍有巨大增量空間有待釋放。
但需要注意的是,奧拉帕利化合物將于2024年3月到期,制劑專利在2029年10月到期,國內齊魯制藥、科倫制藥、石藥歐意等企業均已遞交仿制藥申請,上海迪諾、天士力、人福藥業等多家企業也正在排隊涌入PARP抑制劑市場,未來這一領域的競爭將逐漸激化。
公司點評:
3月30日晚間,君實生物發布2022年年度報告。報告期內,公司共實現營業收入14.53億元,同比減少63.89%;歸屬于上市公司股東的凈虧損約23.88億元,同比擴大231.25%;基本每股收益虧損2.6元。
而這也是君實生物自2019年以來,營業收入首次出現負增長。對此,公司在年報中解釋稱,營收同比下降主要系上期公司基于與Eli Lilly and Company、Coherus的合作協議產生了大額技術許可收入和特許權收入,報告期內對應的技術許可收入及特許權收入減少。
從具體產品收入看,君實生物核心產品PD-1特瑞普利單抗(商品名:拓益)在國內市場實現銷售收入7.36億元,同比增長78.77%。
橫向對比最近三年的財報,可以發現特瑞普利單抗的銷售額經歷了相當大的起伏。特瑞普利單抗自2018年底獲批以來,其銷售額經歷一段時間的爬升后在2020年度達到高峰10.03億元,而后由于醫保降價、市場競爭激烈等原因,2021年,銷售額遭遇腰斬,全年僅實現銷售額4.12億元,同比下降58.96%。2022年的銷售情況則有了顯著回暖,公司在年報中稱,隨著公司商業化能力提升,以及新增2項大適應癥獲批上市,特瑞普利單抗在國內市場的銷售情況已逐步進入正向循環。
2、切入自免領域,藥明巨諾CAR-T瑞基奧侖賽系統性紅斑狼瘡適應癥獲批臨床
2023年4月10日,藥明巨諾宣布,瑞基奧侖賽注射液(簡稱relma-cel)用于治療中重度難治性系統性紅斑狼瘡(SLE)的新藥臨床試驗申請(IND)已獲得中國國家藥品監督管理局的默示許可。
已發表在新英格蘭醫學雜志、自然醫學雜志上的臨床研究結果顯示,靶向CD19的CAR-T細胞治療SLE患者療效顯著。Relma-cel有望為中重度SLE患者提供一種全新的、安全有效的治療選擇。
藥明巨諾稱,上述研究是一項關于難治性系統性紅斑狼瘡成人患者的開放、單臂、多中心的I/II期研究。I期研究為劑量爬坡研究,旨在評估relma-cel的安全性、耐受性,并確定II期推薦劑量(RP2D)。作為擴展性研究的II期研究將應用RP2D治療中重度難治性SLE患者,以確定relma-cel在中重度難治性SLE患者中的療效與安全性,并評估藥代動力學和藥效學特征。
行業洞察:
據了解,系統性紅斑狼瘡是一種復雜的自身免疫性疾病,可引起全身多臟器和組織受損。據估算,目前中國約有100萬名系統性紅斑狼瘡患者。近年來,系統性紅斑狼瘡患者的長期生存雖有所改善,但不可避免的疾病復發及其導致的不可逆的器官損傷仍是系統性紅斑狼瘡患者死亡的重要原因。系統性紅斑狼瘡患者的死亡率是普通人群的3至4倍。因此急需創新的治療手段實現疾病癥狀的持續緩解,控制器官損害,改善患者長期生存。
瑞基奧侖賽注射液針對系統性紅斑狼瘡的適應癥獲批臨床,意味著該CAR-T療法在血液瘤之外,也開始切入自身免疫領域。平安證券研報指出,自身免疫疾病是由于機體免疫系統被錯誤導向攻擊宿主自身所引發的疾病。正常情況下,人體免疫系統僅識別和清除外來或危險物質,然而,當功能出現異常,免疫系統可能會對自身組織的抗原產生自身免疫反應,并對其進行攻擊,產生炎癥和組織損傷,而慢性炎癥或損傷將進一步導致自身免疫病。
截至目前,全球已發現超過100種自身免疫病,包括全身性免疫疾病和器官特異性免疫疾病,患者人數眾多。據估計,全球約有7.6%~9.4%的人群患有自身免疫性疾病。中國目前自身免疫疾病發病率尚無確切數據,不過患者人群在逐年增加,其中較為常見的主要包括慢性鼻竇炎、特應性皮炎、哮喘、銀屑病、類風濕關節炎等,患者規模較大,已經成為除心血管疾病和癌癥外第三大慢性病。
從市場空間上看,由于自身免疫病難以治愈,同時病情反復持久,嚴重影響生活質量,因此患者通常具有較強的用藥意愿,且需要長期甚至終身服藥。考慮到巨大的患者基數以及長期高頻的用藥方式,自身免疫治療賽道展現出良好的市場前景。有數據顯示,2021年全球銷售額TOP100藥品的合計銷售規模約4519億美元,其中自身免疫藥物為794億美元,占比18%。
對于自免這一重要賽道,跨國藥企也是動作頻頻。繼輝瑞擬“豪擲”430億美元收購ADC巨頭Seagen一個月后,原本屬意ADC賽道的默沙東也將眼光投向了自免領域,近日,其宣布擬以每股200美元、108億美元的總金額收購生物科技公司Prometheus,這筆交易預計將于今年第三季度完成。通過此次收購,默沙東將獲得Prometheus研發管線中一種有前景的潰瘍性結腸炎和克羅恩病的實驗性治療方法,并擴大其在自免領域的影響力。
公司點評:
3月29日,藥明巨諾發布2022財年年報。公司在報告期內實現營業收入1.46億元,同比增長373.10%,歸屬母公司凈虧損8.46億元,虧損同比擴大20.48%。
財報披露,在過去一年,瑞基奧侖賽一共開具了165張處方,完成141例患者的回輸。盡管與2021年的3079.7萬元相比,銷售業績增長了373.1%,但其銷售開支也由2021年的1.71億元增加至1.91億元,甚至高于其1.46億元的營收。對此,藥明巨諾表示,這主要由于員工成本增加,以及2022年全面開展商業活動以全力支持瑞基奧侖賽的商業化,令業務推廣費增加。
國內上市的另一款CAR-T產品是復星凱特的阿基侖賽注射液,目前尚未有詳細的銷售數據披露。不過,據復星醫藥2022年年報,截至2023年1月末,阿基侖賽已治療近300位復發或難治性大B細胞淋巴瘤患者。而在2021年年報中,復星醫藥曾披露,截至2022年2月末已有約百名患者進入CAR-T細胞治療流程。按此計算,阿基侖賽的年處方量也只是稍多于瑞基奧侖賽,兩者差距不大。
復星醫藥董事長吳以芳曾對《掘金創新藥》研究員表示,目前,作為一種個性化藥物,CAR-T的治療費用依舊很高,怎么在現有基礎上降低成本、提高患者的用藥可及性依舊是一大方向。此外,接下來,如何拓寬CAR-T的市場應用前景也需要進一步關注,行業需要進一步在血液瘤的基礎上探索實體瘤領域的發展可能。“復星醫藥也做了探索,并發現CAR-T不僅在腫瘤治療上,實際上在一些免疫性疾病方面,也發現了非常可喜的一些進展和潛在的機會。”
研究員認為,CAR-T產品自獲批以來,其可及性問題一直備受關注,各家在提高工藝、降低成本的同時,也在積極推進CAR-T產品向血液瘤以外領域的突破。從這一點上而言,藥明巨諾與復星醫藥在自免領域的探索也就不謀而合。
需要引起警惕的是,CAR-T產品所處的CGT(細胞與基因治療)賽道也存在發展不及預期的風險,尤其是2023年以來,就連國內CGT CDMO龍頭藥明康德也由于現實原因對其子公司藥明生基臨港生產基地做出了大量裁員、關閉生產線等業務調整。研發費用、生產成本高企導致CGT療法定價難以實現可及性,原本藥企還可通過CDMO將生產的高成本分攤,但如今連CDMO代工都沒有辦法規模化降低成本,這等于是給所有想要入局CGT療法的企業敲響了警鐘。
封面圖片來源:每日經濟新聞 劉國梅 攝
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
