每日經濟新聞 2024-07-18 18:31:35
◎7月15日,天境生物(IMAB.US)宣布,公司董事會任命傅唯為董事會主席。傅唯將接替Pamela M.Klein,后者將卸任天境生物董事會和臨時董事長一職。
每經記者 許立波 每經編輯 楊夏
7月15日,天境生物(IMAB.US)宣布,公司董事會任命傅唯為董事會主席。傅唯將接替Pamela M.Klein,后者將卸任天境生物董事和臨時董事長一職。而就在數月之前,Pamela M.Klein剛剛接替了前任董事長、天境生物創始人臧敬五的職位,擔任過渡時期的臨時董事長。
官網資料顯示,傅唯自2018年6月起至今任天境生物董事。傅唯從2014年4月起被任命為康橋資本的首席執行官及董事總經理,該公司為一家專注于醫療健康產業投資的私募股權公司。同時,康橋資本也是天境生物的創始股東及最大股東。
值得注意的是,今年以來天境生物已進行了多次高層人事變動。今年2月,天境生物宣布剝離在中國的資產,國內重新組建天境(杭州)公司,臧敬五隨即從天境生物離職,專注于天境(杭州)公司的領導工作。
據悉,天境生物是一家從臨床階段正邁向商業化的全球創新生物制藥公司,致力于創新生物藥的靶點生物學研究、抗體工藝及中美臨床開發和產品商業化。
資本市場上,天境生物于2020年1月中旬在美國納斯達克上市,發行價為14美元,募資金額超過1億美元。公司的“高光時刻”則發生在2020年9月,彼時,天境生物依靠其核心管線——CD47來佐利單抗(lemzoparlimab)成功與知名跨國藥企艾伯維達成合作。
根據協議條款,艾伯維將向天境生物支付1.8億美元的首付款以獲取來佐利單抗相關授權,同時將額外支付2000萬美元作為1期臨床研究結果的里程碑付款,總計2億美元。此外,天境生物將有資格獲得來佐利單抗項目最高可達17.4億美元的里程碑付款,其中臨床開發和監管注冊的里程碑付款為8.4億美元,其余付款則基于銷售里程碑。

這筆潛在總金額接近30億美元的交易曾在當時刷新了中國生物醫藥企業向海外授權交易的金額紀錄。此后,包括來佐利單抗、菲澤妥單抗(治療多發性骨髓瘤和系統性紅斑狼瘡的差異化CD38抗體)在內,天境生物同時推進多達十余項創新藥研發管線,在當時看來研發進展似乎都順風順水,因此也助推公司股價在2021年6月末達到歷史高點85.4美元/股,市值將近70億美元。
然而,事實證明,來佐利單抗的臨床研究并未如預期般推進。2022年8月,艾伯維就決定停止來佐利單抗聯合阿扎胞苷和維奈托克(venetoclax)治療骨髓增生異常綜合征(MDS)和急性髓系白血病(AML)的全球1b期臨床試驗。而天境生物則在同一時期宣布,修訂與艾伯維的CD47抗體全球戰略合作協議,盡管天境生物方面稱雙方還會繼續在抗CD47抗體療法的全球開發方面進行合作,但業內普遍認為兩者的合作已在此時出現裂痕。
2023年9月,天境生物發布公告稱,艾伯維已終止與該公司在2020年共同開發和銷售的CD47抗體候選藥物來佐利單抗的協議。公告還解釋稱,艾伯維全面終止合作協議是基于先前項目的終止和艾伯維的戰略決策,終止協議于2023年11月20日生效。
成也艾伯維、敗也艾伯維。作為一家尚未有產品實現商業化的創新藥企業,天境生物的現金流嚴重依賴外部融資以及來佐利單抗、菲澤妥單抗兩款核心管線的推進情況。隨著全球范圍內醫藥產業投融資遇冷,天境生物也每況愈下。
有接近天境生物的知情人士稱,隨著2021年夏天中概股以及創新藥到達“最后的狂歡”,此后資本一路退潮。天境生物在2022年還在積極做著管線的研發,到處去見投資者尋求再融資;但到了2023年,隨著整個行業投融資的遇冷,絕大部分藥企都融不到錢,天境生物也明顯就只能依靠著賬上“存糧”維持經營,“從2022年開始(公司經營)情況就不樂觀了,到2023年則是非常嚴峻了”。
今年2月,天境生物發布公告,宣布重要戰略和人事調整,公司稱已簽署協議剝離其在中國的業務和資產,專注于美國業務。天境生物表示,作為公司向美國生物技術公司轉型戰略的一部分,已與天境生物科技(杭州)有限公司(下稱“天境生物(杭州)”)簽署最終協議,將剝離公司在中國的資產和業務運營。
此外,對于前述企業變動,天境生物曾對多家媒體表示,這是一次戰略重組,未來,上市公司天境生物(I-Mab)將按照美國生物科技(Biotech)公司的路線發展,天境生物(杭州)將按照中國生物科技公司的路線發展,雙方均實現價值最大化且不桎梏彼此;同時,投資人結構與各自市場更加匹配,并更好規避中概股投資風險,有利于上市公司估值回歸。
作為一項能廣泛表達在不同癌細胞上、具備泛癌種治療潛力的“夢幻”靶點,CD47曾被業內寄予厚望,甚至被認為有望復制PD-1的成功。然而這一夢幻靶點,何以導致了一家明星創新藥公司的敗退?
實際上,折戟在CD47靶點上的藥企并不止天境生物和艾伯維兩家,例如CD47靶點先行者的吉利德,其CD47單抗Magrolimab的兩個核心臨床試驗都以失敗告終;另一家跨國藥企羅氏對CD47的探索也均碰壁。
今年2月7日,吉利德宣布已終止其CD47單抗Magrolimab用于治療急性髓性白血病(AML)的Ⅲ期ENHANCE-3研究,FDA將所有Magrolimab針對骨髓增生異常綜合征(MDS)和AML的研究(包括相關的擴展研究項目)置于全面臨床擱置狀態。原因是IDMC評估最新數據發現Magrolimab+阿扎胞苷+維奈克拉無治療效果且增加了死亡風險(主要由感染和呼吸衰竭引起)。
艾伯維/天境生物方面,雙方始終未透露終止來佐利單抗全球1b期臨床試驗的具體原因,但明確并非涉及任何安全性問題。此外,業界普遍認為,多數在研CD47靶點藥物無法妥善解決與紅細胞親和力過高的問題,因此造成安全性和有效性難以兩全。
宜明昂科董事長田文志曾向《每日經濟新聞》記者解釋其中的原因。他表示,CD47除了在腫瘤細胞表面表達,也在血細胞,尤其是紅細胞表面表達,而抗體的高親和力導致其與紅細胞不可避免的結合。即使有的抗體通過設計優化減少跟紅細胞的結合,但也很難避免與其他血液細胞結合帶來的“抗原沉默”效應。為了使足夠的藥物能進入腫瘤部位發揮療效,必須加大劑量,從而增加了安全性風險。
“你會發現無論是艾伯維/天境生物還是吉利德的CD47抗體藥,它們的臨床用藥劑量都非常高(如Magrolimab的劑量就高達30毫克每公斤體重)。劑量一上來,整體安全性就受不了了,這是一個矛盾點,也是一個死結,解決不了的。”田文志表示。
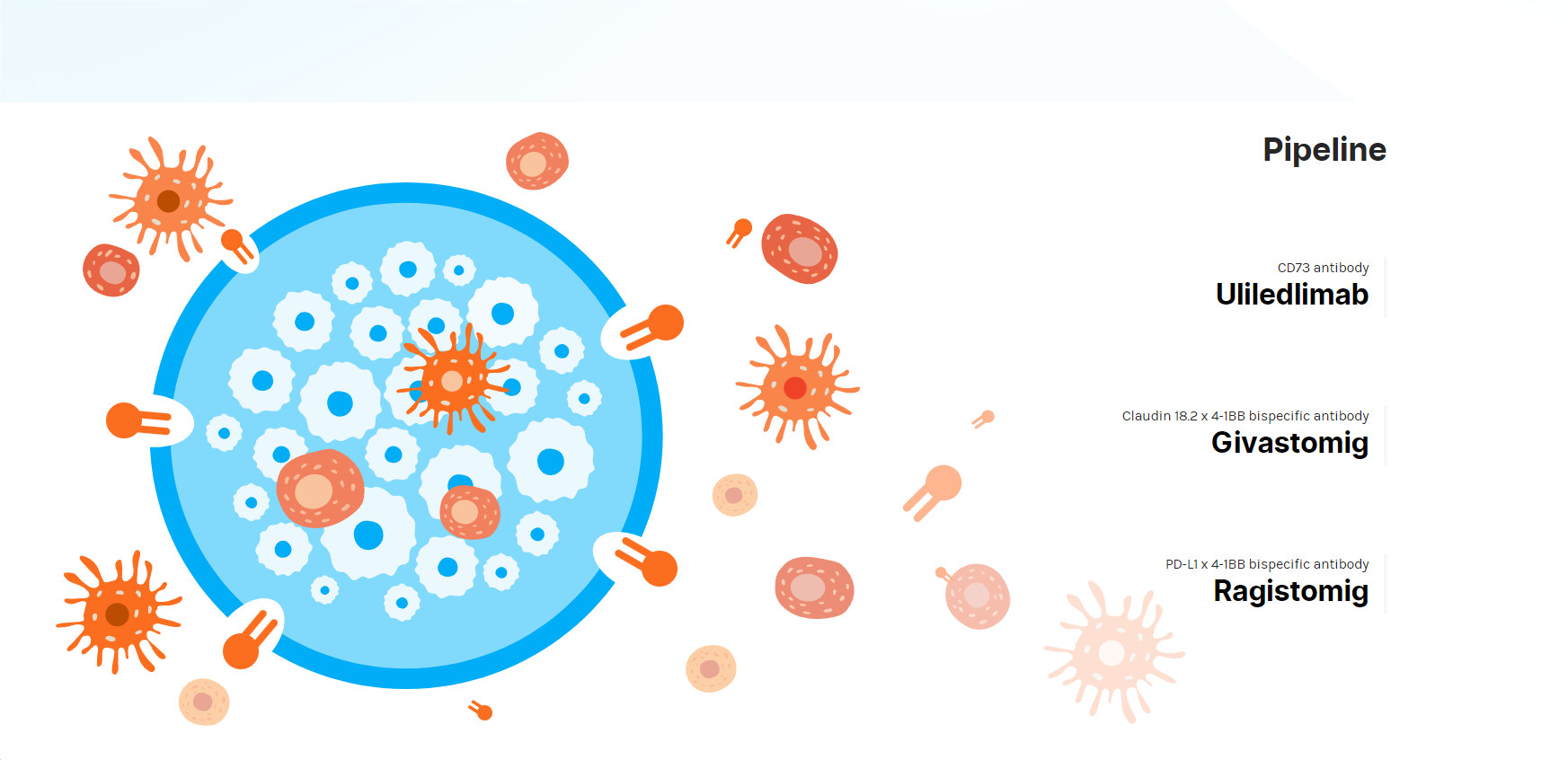
宣布剝離在中國的資產后,目前上市公司天境生物的官網頁面僅剩下三項創新管線,分別為Uliledlimab(尤萊利單抗,CD73抗體)、Givastomig(Claudin 18.2 x 4-1BB雙特異性抗體)以及Ragistomig(PD-L1 x 4-1BB雙特異性抗體)。這三款產品中,進展最快的尤萊利單抗處于臨床Ⅱ期,天境生物稱將在2024年下半年啟動尤萊利單抗聯合化療以及免疫檢查點抑制劑治療非小細胞肺癌(NSCLC)的Ⅲ期臨床試驗。
傅唯接手后,能否調整戰略布局,讓失去了CD47靶點的天境生物重新走上正軌,也尚待時間驗證。
封面圖片來源:天境生物官網
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
