每日經濟新聞 2024-12-03 16:54:50
今年8月6日,全球首個治療IDH突變型彌漫性腦膠質瘤的靶向藥物Vorasidenib在美國獲批;11月24日,國內首張處方在四川大學華西樂城醫院開出,相關真實世界研究也將在博鰲樂城展開。該藥物可延遲放化療副作用,為患者爭取更長生存時間,目前已納入海南樂城特藥險的進口藥品清單。
每經記者 林姿辰 每經編輯 楊夏
2020年春節,一次毫無征兆的癲癇后,劉一土(化名)的人生迎來一位叫“腦膠質瘤”的不速之客。當27歲的她從醫生口中聽到“術后可能癱瘓”的提醒,猶如晴天霹靂。
不過,幸運眷顧了這個主動發帖、幫助病友的姑娘。經歷了兩次手術后,最壞的結果還未降臨,劉一土清醒地知道,自己揣著一顆定時炸彈,一顆所有腦膠質瘤患者都揣著的炸彈——復發。
腦膠質瘤是一種兇險的罕見疾病,盡管國內發病率只有5/10萬~8/10萬,但5年病死率僅次于胰腺癌和肺癌。過去,患者可選的治療手段只有手術、放療、化療,由于外科手術很難徹底切除,放化療會傷害神經認知功能,很多患者還可能面臨的另一種困境是殘疾。
而在今年,持續了近20年的研發僵局被打破了。8月6日,全球首個用于治療IDH突變型彌漫性腦膠質瘤的靶向藥物Vorasidenib在美國獲批;11月24日,國內首張處方在四川大學華西樂城醫院開出,相關真實世界研究也即將在博鰲樂城拉開序幕。
當天,患者組織“遞愛之家”創始人孫文軍坐在臺下,眼前閃過了一條“緩沖帶”。在那里,符合條件的膠質瘤患者可以盡可能地推遲放化療帶來的副作用;更重要的是,患者和他們的家人能看到希望——“如果有一個新的技術,讓我們還能多出五年的時間,那在這五年里,是不是就有可能再出現新的技術,再讓我們延長五年(生命)?在這十年里,問題是不是有可能得到解決?”
當人面臨死亡威脅的時候,就會反思自己的人生。劉一土對人生的反思始于4年前,當時她躺在核磁共振檢查室里,聽著儀器發出斷斷續續的嘟嘟聲,內心的疑問來回翻涌:為什么得病的是我?有哪些事,我本可以做到,卻沒有做?
在那之前,劉一土剛遭遇過一次癲癇的襲擊,被首診為高級別腦膠質瘤,最終在天壇醫院被確診為風險相對較低的低級別腦膠質瘤。27歲的她,被命運無情地推入了一個全新的、陌生的領域——腦部腫瘤。
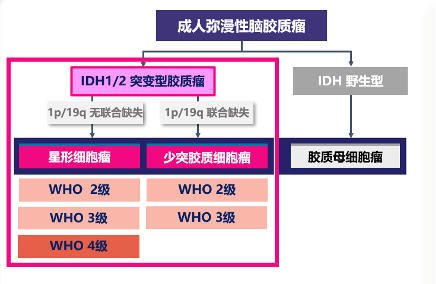
腦膠質瘤是起源于中樞神經系統膠質細胞或前體細胞的腫瘤,約占所有惡性腦腫瘤的80%。根據2021年世界衛生組織(WHO)的分類,腦膠質瘤被分為五大類,其中成人型彌漫性膠質瘤占比約70%,這其中又有約40%的患者會出現IDH1或IDH2的突變,他們的中位發病年齡40歲左右,確診之后的中位預期壽命約為3年~14年,期間還要經歷癲癇、記憶及反應下降、運動受限甚至癱瘓等諸多痛苦。
此后,劉一土就邁上了“治療-復發-再治療”的循環。在第一次手術前,醫生曾告訴劉一土,腫瘤緊鄰運動功能區,手術可能導致左側肢體癱瘓;三年后腫瘤復發時,醫生又告訴她手術風險增加,仍可能造成偏癱。
但這兩次,劉一土都堅定地選擇手術,甚至希望醫生能切除更多、避免復發。幸運的是,兩次手術都很成功。腫瘤被成功切除,病理還沒有升級,這已經是她能想到的最好結果。

對復發的恐懼,寄生在每一位腦膠質瘤患者身上。林冬來自施維雅中國醫學科學事務部門,曾經做過10年神經外科醫生。他對一位5年之內做了3次開顱手術的腦膠質瘤患者印象深刻。這位患者發病時42歲,由于腫瘤位于功能區,第一次切除手術后偏癱了;兩年后復發再手術后,只能通過眨眼和簡單說話與外界交流;又過了一年,腫瘤再次增長,盡管林冬在術前談話中明確表示手術結果可能非常不好,但患者家屬還是堅持手術。患者處于植物人狀態,最終因長期臥床導致的重癥感染肺炎和呼吸衰竭去世。
“對于術后病人,復發是一顆定時炸彈,但其實沒有很多可選擇的治療方案。處于癥狀前期的病人在手術之后,還是希望能回歸正常的生活。”林冬說。
根據腫瘤細胞的分化程度,IDH1/2突變型膠質瘤可以分為2級、3級和4級,危險程度隨著級別依次升高。數據顯示,低級別腦膠質瘤約占腦膠質瘤的30%。中國人群低級別膠質瘤(WHO 2級)、間變性膠質瘤(WHO 3級)和膠質母細胞瘤(WHO 4級)的中位生存時間分別約為78.1、37.6和14.4個月。
劉一土確診的低級別級膠質瘤約占腦膠質瘤的30%,這類患者可能有幾年到十幾年的穩定生存期。在美國,這部分患者的5年生存率達到74.6%左右,中國的5年生存率區間在9%到67%之間。
“國內各地的治療水平差異非常的大,很多人會集中到中心醫院做治療,大部分患者和家屬在整個治療過程中能見到主治大夫的時間不超過十分鐘。”說這句話的孫文軍,已經服務過近萬例患者家庭,見證了太多患者就診路上的酸甜苦辣。
例如,一位20多歲的浙江小伙子第一次手術后的病理免疫組化結果顯示為2級膠質瘤,結合基因檢測結果被判定為4級膠質瘤。但遞愛之家幫他到北京知名醫院遞送病理報告后,專家診斷結果為極其罕見的混合性神經元膠質瘤1級,屬于良性腫瘤。目前,這位患者保持定期復查,已經恢復了正常生活。
由驚變喜的案例萬里挑一,大部分癌癥大病患者在診療中逐漸陷入絕望,壓垮他們的最后一根稻草,往往是不斷出現的副作用。
林冬告訴記者,目前業內并未對低級別腦膠質瘤的治療方案形成統一意見,臨床醫生多參考高級別腦膠質瘤“手術+術后放/化療”的標準治療方法。但低級別膠質瘤常位于或靠近重要功能區,海外一項研究顯示,這些患者中實現手術全切除的和次全切除的比例僅為11.9%和38.9%,術后約有26%的人神經功能的缺損和障礙。
另外,長期放療會導致患者執行能力、心理運動功能、注意力和工作記憶等評分均明顯下降,臨床上最常用的經典化療藥物,還可能存在導致腫瘤加速惡化的風險。
林冬援引的數據顯示,在既往接受化療的復發型的少年新型膠質細胞瘤患者中,約有47.7%存在超突變,發生超突變的患者中,又有93.5%左右最終轉化為高級別腦膠質瘤。另外,既往接受化療的低級別膠質瘤患者中,最終約80%會轉化為高級別膠質瘤,其中超過一半是發生了超突變。
“這些數據不是在污名化目前現在的標準療法,只是證明了患者確實存在很大的未被滿足的需求。”林冬說。
對于膠質瘤患者來說,2024年是個好年份。8月4日,VORANIGO(Vorasidenib)獲得美國食品藥品監督管理局(FDA)批準正式上市,適用于攜帶IDH1或IDH2突變的2級星形細胞瘤或少突神經膠質瘤的12歲及以上成人和兒童患者的手術(包括活檢、次全切除術或全切除術)后治療。
Vorasidenib是近20年來IDH突變型彌漫性腦膠質瘤治療領域的首個創新靶向藥物,可以更加精準、安全地“狙擊”腫瘤細胞。III期臨床試驗數據顯示,Vorasidenib組中位無進展生存期為27.7個月,安慰劑組為11.1個月;Vorasidenib組的中位TTNI(下一次干預時間)尚未達到,安慰劑組為17.8個月;Vorasidenib組每6個月的腫瘤體積平均減少2.5%,安慰劑組隨機患者每6個月的腫瘤體積平均增加13.9%。
目前,Vorasidenib已被納入2024美國國家綜合癌癥網絡(NCCN)指南和《中國抗癌協會腦膠質瘤診療指南》(2024版),11月24日,國內首張處方在四川大學華西樂城醫院開出。這家醫院設立于2013年的海南博鰲樂城國際醫療旅游先行區(下稱“樂城”),是樂城開業運營的17家醫療機構之一,可以使用國外已上市、但國內尚未上市的臨床急需進口藥械。
據開方醫生——四川大學華西醫院、四川大學華西樂城醫院劉艷輝教授介紹,國內首位用上Vorasidenib的患者是56歲的成都女士,第一次手術已經做了最大范圍的安全切除,如果按照傳統治療應該做放療,但患者對放療存在諸多顧慮,最終選擇了Vorasidenib。
當天,參加Vorasidenib真實世界研究會的孫文軍還在醫院偶遇了一位自費前往樂城的上海姑娘,她同樣為Vorasidenib而來。孫文軍認為,患者看重Vorasidenib的兩個主要價值,一是盡可能延遲放化療等傳統治療方案所帶來的副作用;二是爭取更長的生存時間,有望看到更多治療手段出現。
目前,Vorasidenib已經納入海南樂城特藥險的進口藥品清單。根據相應的規定,海南居民既往癥人群可享受30%比例的藥品報銷,對于健康參保人報銷比例可達100%。
11月24日,施維雅中國總經理Manuel RUIZ主動面對媒體提及了中國醫保和商業保險。他表示,公司希望能夠加快Vorasidenib在中國獲批上市,“之后將啟動申請進入醫保,讓價格降到最低”。
隨著創新藥械先行先試政策在國內多地開展,越來越多的外國制藥企業將國際多中心臨床試驗轉移到中國。Manuel RUIZ表示,到訪樂城后,他看到中國的監管部門想借助一切創新路徑,讓中國患者與歐美患者在同時間享受到創新藥物治療。以Vorasidenib為例,中國的患者甚至比歐洲患者還能更早地接觸到創新藥物治療。
而真實世界研究將在 Vorasidenib的臨床實驗中發揮重要作用。劉艷輝表示,一般來說,三期RCT(隨機雙盲對照研究)是創新藥物正式獲批上市前的最后一步,所需時間大約為3到5年;真實世界研究是指先為出于病情發展需要的患者提供創新藥物,之后再觀察患者用藥后的系列數據改變。從科學的角度看,這種研究也有一套嚴格的管理體系,但可以將患者使用國際領先藥物的時間差距縮短至一年甚至半年,大大提高藥物獲批速度。
這對渴望進入中國市場的跨國藥企極具吸引力。Manuel RUIZ告訴《每日經濟新聞》記者,施維雅中國現在已經變成了施維雅全球在腫瘤領域的主要的分公司,一個主要的原因是公司看到中國正在非常努力地融入全球研發,目前公司還在北京天竺綜合保稅區、粵港澳大灣區努力,希望能夠推進Vorasidenib在當地落地,之后還可能探索在天津、上海等的機會。
另外,施維雅曾在2022年發布過一個數字,計劃將大約50%的研發預算投入到腫瘤領域,目前這個數字增長到了70%,進一步明確研發方向為難治性腫瘤的靶向和創新療法。
“在過去的幾十年中,高血壓、心絞痛或心衰領域的發展已經放緩,創新藥物的開發空間日趨飽和,公司相應進行了戰略調整,希望進入長期缺乏創新治療方式的少見且難治性腫瘤領域,其中實體瘤涉及膽管癌、軟骨肉瘤、膠質瘤,血液腫瘤涉及急性髓系白血病、骨髓增生異常綜合征等。”
據Manuel RUIZ透露,目前公司還有一個針對高級別腦膠質瘤的研發計劃,在早期階段已經引入中國患者,關于Vorasidenib與替莫唑胺聯合用藥的早期研究,公司已經向CDE(國家藥品監督管理局藥品審評中心)提交了臨床研究申請。
封面圖片來源:視覺中國-VCG4192118984
如需轉載請與《每日經濟新聞》報社聯系。
未經《每日經濟新聞》報社授權,嚴禁轉載或鏡像,違者必究。
讀者熱線:4008890008
特別提醒:如果我們使用了您的圖片,請作者與本站聯系索取稿酬。如您不希望作品出現在本站,可聯系我們要求撤下您的作品。
歡迎關注每日經濟新聞APP
